Природа - соль
Cтраница 1
Природа соли зависит от смешивающихся кислот и щелочей. Так, все соли натрия растворимы, соли кальция при высоких концентрациях могут быть нерастворимыми. Например, известь Са ( ОН) 2 образует осадок с серной, фтористоводородной и фосфорной кислотами. Выбор химически нейтрализующего агента зависит от его стоимости, в которую входит и стоимость удаления осадка. [1]
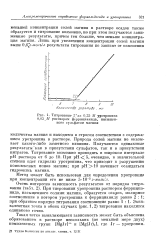 |
Титрование З мл 0 25 М уротропина. [2] |
Природа солей магния не оказывает какого-либо заметного влияния. Получаются одинаковые результаты как в присутствии сульфатов, так и в присутствии нитратов. При рН 5, очевидно, в значительной степени идет гидролиз уротропина, что приводит к разрушению комплексных ионов магния; при рН - 10 начинает осаждаться гидроокись магния. [3]
Природа соли переходного металла также оказывает большое влияние на выход продуктов взаимодействия ЗМБ1 с комплексными металлоргани-ческими катализаторами. Как известно, замена Т1С14 на a - TiQ3 в каталитическом комплексе способствует увеличению выхода полимера. Однако в случае ЗМБ1 эта закономерность справедлива только при больших концентрациях катализатора. С понижением концентрации каталитического комплекса активность Т1С14 А1 ( С2Н5) 3 и TiCl4 А1 ( мзо - С4Н9) 3 по сравнению с активностью TiCl3 А1 ( мзо - С4Н9) 3 в реакции полимеризации повышается. Выход изомеров ( 2МБ2) с увеличением концентрации катализатора проходит через максимум, однако при использовании TiCl4 А1 ( С2Н5) 3 выход 2МБ2 возрастает с увеличением концентрации катализатора, а выход ПМБ проходит через максимум. [4]
 |
Алкилирование п-толуолсульфината тетраэтиламмония в СН2С12 [ / 5 ]. [5] |
Из-за амбндентной природы сульфннат-иоиа соли сульфиновых кислот при обработке алкилирующими реагентами могут давать как сульфоны, так и эфнры сульфпновых кислот. Как правило, сложные эфнры образуются лишь в случае наиболее реакционно-способных или жестких электрофилов, атака которых направляется на кислород; все остальные реагенты дают только сульфоны. [6]
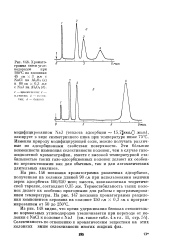 |
Хромато-грамма смеси углеводородов при 100 С на колонках 45 см X 3 мм с NaCl на А1203 ( я и 80 см X 0 3 мм с NaJ на АЦОз ( б. [7] |
Изменяя природу модифицирующей соли, можно получать различные по адсорбционным свойствам поверхности. Эти большие возможности изменения селективности колонок, чем в случае газожидкостной хроматографии, вместе с высокой температурной стабильностью таких газо-адсорбционных колонок делают их особенно перспективными как для обычных, так и для автоматических длительных анализов. [8]
В зависимости от природы солей и температуры пара вынесенные из котла соли отлагаются преимущественно либо в перегревателе, либо в турбине. Твердые, не плавящиеся при высокой температуре соли, такие, например, как сернокислый натрий, отлагаются, главным образом, в перегревателях, где происходит безостаточное выпаривание унесенной из котла влаги. Плавящиеся при высокой температуре соли ( например, едкий натрий, сода) проносятся через перегреватель и осаждаются в тех ступенях турбин, где температура пара становится ниже температуры плавления солей. Вынесенна Я из котла кремниевая кислота также обычно отлагается в турбине. При больших давлениях занос солей в турбину относительно больше, а осаждение солей в перегревателе относительно меньше, чем при меньших давлениях. [9]
В ависимости от природы соли эта реакция может сопровождаться азлич-ными побочными процессами. [10]
Для правильного понимания природы солей полезно заметить, что углекислый газ, растворяясь в воде, развивает тепло, раствор диссоциирует легко, выделяет СО - по закону Генри-Дальтона ( гл. Он же, растворяясь в едком натре, дает или среднюю соль Na - CO3, не выделяющую СО2, или кислую соль NaHCO3, которая легко при нагревании выделяет 1 / 2 СО2, Тот же газ, растворяясь в растворах солей, действует и тем и другим образом. Здесь видно, какой последовательный ряд отношений существует между соединениями различного порядка, образующими тела различной степени прочности. Резко выделяя растворение от химического соединения, мы бы не могли видеть тех естественных переходов, какие существуют в действительности. [11]
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что. [12]
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. [13]
Степень гидролиза определяется природой соли, ее концентра цией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. [14]
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. [15]
Страницы: 1 2 3 4