Природа - адсорбционный центр
Cтраница 1
Природа адсорбционных центров и адсорбционных связей в области высоких анодных потенциалов существенно отличается от таковых в области низких потенциалов, поскольку важную роль в формировании этих центров, очевидно, играют оксиды платины. Разные формы хемосорбированного кислорода ведут себя различно по отношению к процессу хемосорбции органических веществ, показывая неодинаковые способности к вытеснению органическими частицами и окислительную активность. По-видимому, имеет место включение хемосор бированных органических частиц в окисную ленку. V 1OB является, например, близость адсорбируе-мости на окисленной платине третичных алифатических спиртов и их гомологов с неразветвленной цепью. Слабая адсорбируе-мость третичных ширтов в области низких потенциалов объясняется отсутствием в их молекуле наиболее легко отщепляемых атомов водорода у а - С-атома. [1]
Установлено, что природа каталитических и адсорбционных центров различна, так как значения адсорбционных коэффициентов, вычисленные из кинетических данных, отличаются в сто раз от величин адсорбционных коэффициентов, найденных из измерений адсорбции. [2]
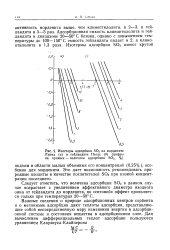 |
Изостеры адсорбции ЗСЬ на мордените Липча ( а и гейландите Пегас ( б ( цифры на прямых - величина адсорбции SO2, %. [3] |
Важные сведения о природе адсорбционных центров сорбента и о механизме адсорбции дают теплоты адсорбции, представляющие собой непосредствейную меру изменения энергии в адсорбционной системе и состояния вещества в адсорбционном слое. [4]
В этом случае энергия активации Е определяется природой адсорбционных центров и характеризует энергию образования этих центров. Если молекулы различных сортов адсорбируются на центрах различных типов, отличающихся значением Ев ( 5), то в этом случае энергия активации оказывается зависящей не только от природы адсорбента, но в конечном счете и от природы ад-сорбтива. [5]
Заканчивая обзор работ по использованию ИК-спектроскопии в исследовании химии поверхности цеолитов, изучении природы адсорбционных центров и тех изменений поверхности, которые происходят при взаимодействии с адсорбатами, можно сделать следующие выводы. [6]
 |
Принципиальная схема поверхности снликатеяя со свободной ( я, реактивной ( б я связанной ( в гидроксильными группами, а также с силоксановой группой ( г. [7] |
Рассмотрим более подробно свойства адсорбентов, наиболее часто используемых для разделения нефтепродуктов: структуру их поверхности и ее изменение при обработке адсорбента, природу адсорбционных центров и сил адсорбции, селективность адсорбента к классам соединений, входящих в состав нефтепродуктов. [8]
Представляет интерес сопоставить значения адсорбционных коэффициентов, вычисленных из кинетических данных, со значениями адсорбционных коэффициентов, найденных непосредственно из измерений адсорбции, поскольку это дает возможность определить, одинакова или различна природа каталитических и адсорбционных центров. Если значения адсорбционных коэффициентов, определенных двумя методами, сильно отличаются друг от друга, то это однозначно определяет различную природу каталитических и адсорбционных центров. [9]
Изменения в природе адсорбционных центров, обусловленные облучением, оценивались по адсорбции криптона. Рентгенографические измерения показали, что облучение приводит к сжатию решетки со смещением некоторых атомов относительно своего нормального положения. [10]
Спектры тиофена, адсорбированного на цеолитах в Са - и Н - фор-мах и на окиси алюминия, очень близки. Это сходство, вероятно, определяется аналогичной природой адсорбционных центров. Хорошо известно, что поверхность окиси алюминия содержит лью-исовские кислотные центры. Значительная концентрация этих центров обнаружена и на декатионированных цеолитах, прогретых при 550 С. Судя по изменениям в спектре тиофена, адсорбированного цеолитом CaY, можно предположить наличие специфических взаимодействий адсорбированного тиофена с катионами, однако подробно этот вопрос не рассматривался. [11]
Иначе говоря, предполагают, что число адсорбционных центров ( на единице поверхности) является постоянным ( раз и навсегда заданным), определяемым природой поверхности и не меняющимся с температурой. Это предположение, однако, может оказаться неприемлемым при определенной природе адсорбционных центров. [12]
Наиболее интересные результаты были получены при измерении теплот адсорбции бензола. Благодаря способности к специфическому взаимодействию с катионами бензол удобен для изучения природы адсорбционных центров в цеолитах. При обмене Na на Са2 последние сначала занимают места внутри шестичленных кислородных мостиков ( Si), и при этом адсорбционные свойства не изменяются. При увеличении степени обмена на стенках полостей появляются центры 8ц, занятые ионами Са2 и свободные от катионов. Число центров каждого типа зависит от соотношения Si02 / / А1203 и от степени ионного обмена. [13]
Наиболее интересные результаты, были получены при измерении теплот адсорбции бензола. Благодаря способности к специфическому взаимодействию с катионами бензол удобен для изучения природы адсорбционных центров в цеолитах. При обмене Na на Са2 последние сначала занимают места внутри шестичленных кислородных мостиков ( Si ], и при этом адсорбционные свойства не изменяются. При увеличении степени обмена на стенках полостей появляются центры 8ц, занятые ионами Са2 и свободные от катионов. Число центров каждого типа зависит от соотношения Si02 / / А1203 и от степени ионного обмена. [14]
Строение поверхности силикатных слоев. Для точного расчета величин усредненных диффузией ЛМП на протонах молекул воды необходимы данные о природе адсорбционных центров, удерживающих молекулы воды в межслоевом пространстве. [15]
Страницы: 1 2