Природа - адсорбционный центр
Cтраница 2
 |
Схема энергетических уровней молекул СО и NO. [16] |
Представляло интерес изучить состояние катионов Си2 в цеолитах, особенно тех, которые обладают высокой каталитической активностью в реакциях окисления, используя метод ИК-спектроскопии адсорбированных молекул. Известно, что на состояние адсорбированной молекулы существенно влияет центр адсорбции, поэтому, исследуя ИК-спектры адсорбированных молекул-тестов и их изменения, можно получать информацию о природе адсорбционных центров. [17]
При исследовании процесса адсорбции рассматриваются как процессы взаимодействия адсорбент - адсорбат, так и процессы взаимодействия адсорбат - адсорбат. Дискутируется вопрос о природе адсорбционных центров на силикагеле. Некоторые авторы утверждают, что единственными центрами адсорбции на двуокиси кремния являются изолированные группы ОН. [18]
Для практического применения цеолитов в большинстве случаев наиболее важными, являются их поверхностные свойства и реакционная способность. ИК-спектроскопия может дать полезную и часто вполне определенную информацию о структуре и поверхностных свойствах цеолитов, а также показать, каким образом они меняются в ходе реакции или при различных обработках. Изменения в спектрах цеолитов и адсорбированных молекул позволяют непосредственно судить об особенностях поверхности, характере адсорбции, природе адсорбционных центров и о взаимодействии адсорбированных молекул с этими центрами. [19]
Видно, что подобранные условия гидролиза ПАА позволили устранить деструктивные процессы и тем самым обеспечить практическую идентичность ММ и ММР для всех образцов ГПАА. Величина D уменьшается с ростом ионной силы и при снижении [ ГПАА ] [29] характер зависимости D / ( B) логично связать с изменением среднеквадратичных размеров макро-мрлекулярных клубков ГПАА. Фиксируемый в эксперименте характер соотношения между зависимостями D ( OCB) и Г ( в) во многом определяется не только природой второго компонента сополимеров АА, но и природой адсорбционных центров на частицах дисперсной фазы. [20]
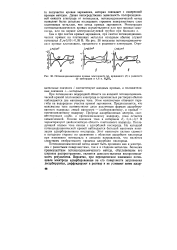 |
Потенциодинамические кривые платинового ( а, иридиевого ( б и родиевого ( в электродов в 4 6 н. HaS04. [21] |
При потенциалах водородной области на анодной потенциодинами-ческой кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается невыясненной. Низкие значения тока в интервале Ег 0 4 - - 0 7 В характеризуют двоинослоиную область платинового водорода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [22]
При потенциалах водородной области на анодной потенциодина-мической кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается не выясненной. Низкие значения тока в интервале фг 0 4 - н 0 7 в характеризуют двойнослойную область платинового электрода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [23]
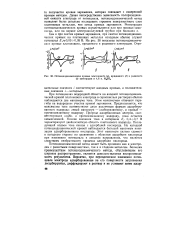 |
Потенциодинамические кривые платинового ( а, иридиевого ( б и родиевого ( в электродов в 4 6 н. HaS04. [24] |
При потенциалах водородной области на анодной потенциодинами-ческой кривой платинового электрода в сернокислых растворах обычно наблюдаются два максимума тока. Этим максимумам отвечают перегибы на водородном участке кривой заряжения. Предполагается, что максимумы тока соответствуют двум различным формам адсорбированного водорода: левый максимум - слабосвязанному, а правый - прочносвязанному водороду. Природа адсорбционных центров, соответствующих слабо - и прочносвязанному водороду, пока остается невыясненной. Низкие значения тока в интервале Ег 0 4 - - 0 7 В характеризуют двоинослоиную область платинового водорода. Последующий подъем тока связан с адсорбцией кислорода. На катодной потенциодинамической кривой наблюдается большой максимум ионизации адсорбированного кислорода. Этот максимум сильно сдвинут в катодную сторону по сравнению с областью адсорбции кислорода при изменении потенциала в анодном направлении, что является следствием необратимости процесса адсорбции кислорода. [25]
Страницы: 1 2