Природа - электрод
Cтраница 1
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [1]
Природа электрода, так же как и степень развития его поверхности, играют важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо она проявляется в случае сложных окислительно-восстановительных реакций. Найдено, что, например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. При плотности тока 0 24 а / см2 на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. [2]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления: особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Найдено, например, что при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксила-мин. При плотности тока, равной 0 24 а / см2, на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. [3]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Найдено, например, что при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. При плотности тока, равной 0 24 а / см2, на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [4]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [5]
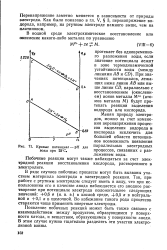 |
Кривые потенциал - рН для воды при 25 С. [6] |
Меняя природу электродов, можно за счет изменения перенапряжения процессов выделения водорода и кислорода исключить для большей области потенциалов возможность появления параллельных электродных процессов, связанных с разложением воды. [7]
Перенапряжение зависит от природы электродов, характера их поверхности, силы тока, температуры и других факторов. [8]
В зависимости от природы электрода и реакции в электрохимической реакции на полупроводниковом электроде могут участвовать электроны из зоны проводимости ( в дальнейшем электроны), из валентной зоны ( дырки) или те, и другие. [9]
На ресурс оказывают влияние природа электрода и реакции, чистота реагентов и электролита, температура и плотность тока и другие факторы. [10]
Константа а зависит от природы электрода, в то время как Ь - только от природы выделяющегося газа. [11]
Константа а зависит от природы электрода, в то время как Ъ - только от природы выделяющегося газа. [12]
Константа а зависит от природы электрода, в то время как 6 - только от природы выделяющегося газа. [13]
Интенсивность обмена зависит от природы электрода и изменяется в широких пределах. [14]
Величина перенапряжения зависит от природы электрода, состава электролита, состояния поверхности электрода, плотности тока и температуры раствора. [15]
Страницы: 1 2 3 4