Природа - электрод
Cтраница 2
Его величина зависит от природы электрода, находящегося внутри стеклянной мембраны. [16]
Ход кривых заряжения зависит от природы электрода. Так, на иридии и родии и в особенности на рутении и осмии адсорбция кислорода начинается при более низких потенциалах, чем на платине, в результате чего происходит сильное перекрывание областей адсорбции водорода и кислорода. [17]
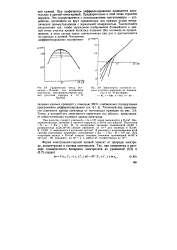 |
Зависимость плотности заряда ртутного электрода от потенциала в 0 1 М растворах. [18] |
Форма электрокапиллярной кривой зависит от природы электрода, концентрации и состава электролита. [19]
Стандартный потенциал ср зависит от природы электрода и характеризует его электрохимическую активность. Для данного растворителя и заданной температуры величина стандартного потенциала постоянна. Абсолютное значение ф определить невозможно, так как с помощью вольтметра измеряют только разность потенциалов двух электродов. Поэтому для измерения ф составляют элемент из стандартного водородного электрода ( СВЭ), потенциал которого условно принимают за нуль при любой температуре, и стандартного исследуемого электрода. СВЭ изображен на рис. 11.4. Он состоит из платиновой пластинки, опущенной в раствор кислоты с активностью ионов водорода, равной единице. [20]
Ход кривых заряжения зависит от природы электрода. Так, на иридии и родии и в особенности на рутении и осмии адсорбция кислорода начинается при более низких потенциалах, чем на платине, в результате чего происходит сильное перекрывание областей адсорбции водорода и кислорода. [21]
Вид электродных реакций зависит от природы электрода и электролита, а также от внешних условий - температуры, наличия примесей и др. В этих реакциях в качестве реагентов или продуктов могут участвовать: а) вещество, из которого состоит электрод; б) компоненты, входящие в состав электролита; в) посторонние вещества ( газы, жидкости, твердые вещества), не входящие в состав электрода или электролита, но имеющие возможность попасть на поверхность электрода или покинуть ее. [22]
Значение нормального электродного потенциала определяется природой электрода и может измениться только при изменении природы его поверхности. [23]
 |
Значение констант о и 6 уравнения Тафеля для реакции катодного выделения водорода на разных металлах. [24] |
Величина перенапряжения на электроде зависит от природы электрода, плотности тока, состава раствора и от других факторов. Перенапряжения на аноде и катоде при определенном электрохимическом процессе в элементе в сумме равны тому избыточному напряжению, которое необходимо приложить к электрической ванне сверх ее равновесной электродвижущей силы, чтобы начался электролиз. В избыточное напряжение кроме перенапряжения на электродах также включается омическое падение напряжения в растворе, соответствующее электросопротивлению этого раствора. Величина перенапряжения различна для разных электрохимических процессов. Так, перенапряжение водорода на ртутном электроде при плотности тока 1 10 4 а / см2 равно 0 94 в. В связи с большим практическим значением реакции выделения водорода для ряда технических процессов ( электролиз воды, хлорный электролиз, эксплуатация аккумуляторов и гальванических элементов, коррозия) эта электрохимическая реакция и соответствующее перенапряжение изучены наиболее детально. [25]
ЭДС простой химической цепи зависит от природы электродов и от средней ионной активности электролита. [26]
Перенапряжение заметно меняется в зависимости от природы электрода. [27]
Природа лимитирующей анодной реакции зависит от природы электрода и электролита. В случае ртутного анода она включает окисление ртути до Hg2; потенциал, при котором протекает эта реакция, определяется природой электролита. [28]
При некоторых условиях, которые определяются природой электрода, составом электролита и плотностью тока, заряд поверхности металла q становится равным нулю. Потенциал такого электрода fq 0, как уже указывалось, называется потенциалом нулевого заряда. [29]
Потенциал разложения электролита изменяется в зависимости от природы электродов. Изменение величины потенциала разложения в зависимости от материала электрода, является результатом различной величины - веляризации. [30]
Страницы: 1 2 3 4