Природа - электролит
Cтраница 2
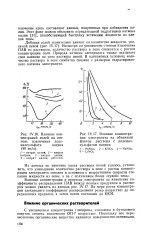
Влияние концентрации и природы электролита на изменение коэффициента распределения ПАВ между пенным продуктом и раствором можно увидеть из данных рис. IV.17. По мере роста концентрации электролита коэффициент распределения резко возрастает до определенных пределов, а затем почти постоянен до ККМ. [17]
В зависимости от природы электролита и коллоидного раствора порог коагуляции изменяется в пределах от 10 - 5 до 0 1 моль в литре золя. [18]
В зависимости от природы электролита и коллоидного раствора порог коагуляции Изменяется в пределах от 10 - 5 до 0 1 моль в литре золя. [19]
Она зависит от природы электролита, природы растворителя ( разные диэлектрические постоянные) и от температуры. [20]
В зависимости от природы электролита различают ХИТ с водными и неводными растворами электролитов, с расплавленными и твердыми электролитами. [22]
На скорость реакции влияет природа электролита, добавляемого в реакционную массу. [23]
Электропроводность раствора зависит от природы электролита, его температуры и концентрации растворенного вещества. Электропроводность разбавленных растворов обусловлена движением катионов и анионов, отличающихся различной подвижностью. [24]
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита / г0 и от температуры. При повышении температуры а увеличивается, так как усиливающееся при этом колебательное движение атомов в молекулах электролита способствует распаду этих молекул на ионы. [25]
Электропроводность раствора зависит от природы электролита, его температуры и концентрации растворенного вещества. Электропроводность разбавленных растворов обусловлена движением катионов и анионов, отличающихся различной подвижностью. [26]
Большую роль играет также природа электролита, в котором происходит окисление амальгамы. Гейровский [9] показал, что галогенид-ионы заметно ускоряют процесс анодного окисления амальгам цинка, олова, висмута и индия, а по мнению других исследователей [10], галогенид - и сульфа-ионы принимают участие в анодном процессе ионизации индия. [27]
Константа диссоциации зависит от природы электролита, температуры и типа растворителя. [28]
Степень диссоциации зависит от природы электролита и концентрации раствора. При введении в раствор слабого электролита одноименных ионов равновесие диссоциации нарушается и смещается в направлении образования недиссоциированных молекул. [29]
Электропроводность раствора зависит от природы электролита, его температуры и концентрации растворенного вещества. Электропроводность разбавленных растворов обусловлена движением катионов и анионов, отличающихся различной подвижностью. [30]
Страницы: 1 2 3 4