Кислотная природа
Cтраница 2
Кислотная природа алюмосиликатных катализаторов и ее связь с каталитической активностью была впервые показана в работе JQ. [16]
Кислотная природа бинарных соединений Э ( I) проявляется при взаимодействии с соответствующими основными соединениями. [17]
Исследование кислотной природы - поверхности алюмосиликатных катализаторов по ультрафиолетовым спектрам поглощения адсорбированных молекул ароматических аминов. [18]
Подтверждением кислотной природы алюмосиликатного катализатора является уменьшение его активности при снижении концентрации водородных ионов, находящихся на его поверхности. Это происходит при обработке катализатора веществами основного характера ( пиридин, хинолин отравляют катализатор), при промывке растворами щелочных солей, при обезвоживании катализатора сильным прокаливанием. [19]
В чем проявляется кислотная природа тех оксидов, которые с водой непосредственно не взаимодействуют. [20]
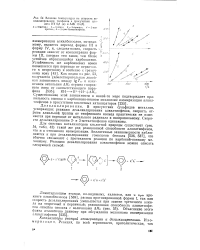 |
Влияние температуры на скорость де-залкилирования тиофенов. в присутствии цеолита HY 0 8 ( а и AISi 10 ( б. [21] |
Для окисных катализаторов кислотной природы существует ( рис. 54, табл. 43) такой же ряд реакционной способности алкилтиофенов, что и в отношении изомеризации. Аналогичные закономерности наблюдаются н при дезалкилировании гомологов бензола [536, 537], что обычно связывают с протеканием реакции по карбоний-ионному механизму. [22]
В присутствии катализаторов кислотной природы пропилен дает олигомеры с очень низкой молярной массой. Эта реакция используется в промышленности для получения смеси ноненов и додеценов, обычно называемых тримером и тетрамером пропилена. Олигомеризация пропилена проводится в газовой фазе над твердой фосфорной кислотой при 200 - 25 0 С и давлении 45 - 25 атм. [23]
Одним из подтверждений кислотной природы каталитической активности алюмосиликатов является отравление этих катализаторов при уда-пении иона водорода с их поверхности. [24]
Установленная в последние годы кислотная природа действия цеолитов в таких основных реакциях углеводородов, как крекинг, изомеризация, алкилирование, полимеризация и другие, обусловливает лишь в общих чертах их сходство с аморфными алюмосиликатами. Однако с точки зрения существующих представлений о механизме действия катализаторов кислотного типа, например в реакциях перераспределения водорода, трудно объяснить столь разительные отличия в селективности аморфных и кристаллических алюмосиликатов. Несомненно, что эти представления требуют уточнений. [25]
Все эти реакции доказывают кислотную природу диоксида кремния. [26]
Все эти реакции доказывают кислотную природу диоксида кремния. Химические свойства кварцевого стекла практически такие же, ка. [27]
Все эти реакции доказывают кислотную природу диоксида кремния. [28]
Предложенная концепция основана на кислотной природе катализатора. Чтобы выяснить, зависит ли активность катализатора только от наличия сочетания алюмосиликата с водой, был приготовлен катализатор без примеси каких-либо других неорганических веществ. В качестве источников окиси алюминия и окиси кремния были использованы этиловый эфир ортокремневой кислоты и изопро-пилат или этилат алюминия. Эти соединения были тщательно перегнаны для отделения от возможных неорганических примесей. [29]
Хотя указанные представления о кислотной природе катализаторов крекинга оригинальны и в некотором отношении представляют интерес, тем не менее они совершенно не разделяются автором настоящей статьи. Прежде всего следует, что предлагающие эту концепцию игнорируют ряд данных, свидетельствующих о том, что протоны могут существовать и действительно существуют на поверхности катализаторов крекинга при таких температурах, при которых считается, что кислота типа Бренстеда не может существовать. Кроме того, чрезвычайно трудно допустить, чтобы поляризующее действие молекул, даже наиболее полярных, как, например, Н2О, могло бы привести к таким изменениям в строении твердого вещества, на какое указывают авторы этой гипотезы. Подвижность ионов кислорода в таких твердых веществах, измеряемая по степени их обмена с кислородом Н2О18 ( в большом избытке) [41], еще we доказывает, что существует такая же подвижность в условиях крекинга, когда количество свободной воды обычно незначительно. И, наконец, нет необходимости предполагать, что для десорбции молекул продукта реакции требуется координационное смещение; последнее не является также и единственным логическим объяснением того факта, что различные основания дают различное число кислотных центров на поверхности катализатора крекинга. Еще более сомнительно, чтобы принцип координационного смещения вообще можно было применять к гетерогенному катализу, пока не будет представлено дальнейших несомненных доказательств универсального характера этой гипотезы. [30]
Страницы: 1 2 3 4