Заполнение - внешняя оболочка
Cтраница 1
Заполнение внешней оболочки возможно только захватом электрона атомом. Чем больше энергия отрыва электрона и чем: меньше энергия присоединения, тем более активно атом присоединяет чужой электрон и хем труднее отдает свой. Использование двух величин для характеристики активности элементов неудобно. В связи с этим вводится понятие относительной электроотрицательности. Существует целый ряд методов ее определения, дающих близкие результаты. Например, по Полингу относительная электроотрицательность некоторых элементов представлена в габл. [1]
Присоединение 1 - 3 электронов может привести к заполнению внешней оболочки, как у идеального газа. [2]
На рис. 4 и в табл. 2 можно легко заметить периодичность в заполнении внешних оболочек электронами. [3]
Однако по числу недостающих электронов водород напоминает группу галогенов ( не хватает до заполнения внешней оболочки одного электрона), и поэтому он может присоединять лишний, второй электрон, образуя, подобно галогенам, отрицательно заряженный ион. [4]
Развертка таблицы на восемь основных групп обнаруживает, что водород, у которого для заполнения s - оболочки не хватает одного электрона, может быть помещен не только в I группе, но и в VII вместе с галогенами, у которых для заполнения внешней оболочки до стабильной конфигурации инертного газа, так же как у водорода, не хватает одного электрона. При этом водород должен быть смещен влево, поскольку он более электроположителен, чем галогены. Хотя наличие у гелия двух внешних электронов на внешнем s - уровне дало формальный повод на первых порах ( см. табл. 6) помещать его условно ( в скобках) также и во II группу, однако отсутствие какого-либо сходства его с бериллием и остальными элементами II группы делает такое размещение совершенно неоправданным. Гелий представляет, таким образом, первый элемент главной подгруппы VIII группы. Литий и бериллий, обладающие одним и двумя - электронами над внутренней заполненной 1 2-оболочкой, здесь, как и в табл. 6, смещены вправо по отношению соответственно к натрию и магнию. Наличие у бора заполненной внутренней 1 2-оболочки под внешними 2з22р1 - электронами проявляется в повышенном ионизационном потенциале ( см. рис. 2), и его необходимо вследствие этого, как и бериллий, сместить вправо. [5]
Волновомехаиическое поведение внешних электронов у атомов элементов III-VI главных подгрупп периодической системы в их соединениях друг с другом определяется правилами целочисленное и насыщенности внешних оболочек восемью электронами. При этом заполнение внешней оболочки s2p8 электронами выполняется путем создания локализованных связей из обобщенных пар электронов. В этом случае число электронов у атома определяет ограниченное число ближайших соседей. Прочное закрепление электронов в локализованных связях предопределяет неионогенный и неметаллический, а полупроводниковый характер подобных соединений. Локализация парноэлектронных связей обусловливает пространственную ограниченность действия химических сил связей. Такие пространственно направленные парноэлектронные связи, в отлр-чие от ионных, являются близкодействующими и потому определяют в основном лишь ближний порядок. [6]
Периодичность свойств элементов, открытая Менделеевым, получает на основе квантовой механики естественное объяснение. Она связана с периодичностью в заполнении внешней оболочки, на которой может быть максимум 8 электронов ( s - и р-термы) и которая определяет не только оптические, но и химические ( см. § 27) свойства атомов. [7]
Согласно теории Льюиса, элементы образуют связи до заполнения внешней оболочки и образования устойчивого октета электронов. Это правило соблюдается, однако, лишь для элементов периодической системы от бора до фтора. [8]
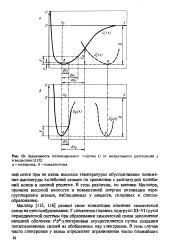 |
Зависимость потенциальной. [9] |
У элементов главных подгрупп III-VI групп периодической системы при образовании химической связи заполнение внешней оболочки 52р6 - электронами осуществляется путем создания локализованных связей из обобщенных пар электронов. [10]
Описание распределения электронов по этажам в атомах различных элементов показывает, что Периодический закон Д. И. Менделеева объясняется слоистым строением электронных оболочек атома. По окончании заполнения одного слоя с замкнутой внешней электронной оболочкой инертного газа происходит аналогичное заполнение следующей внешней оболочки. Поэтому сходство химических свойств атомов и их спектров обусловлено аналогичностью распределения по орбиталям внешних электронов. Наглядно это можно проследить по данным табл. 3, где для каждого элемента указано распределение электронов по орбиталям. [11]
Дальнейшая разработка учения о валентности, объяснение установленной Менделеевым переменной валентности, ее целочисленных значений связаны с изучением внутренней структуры атома. Оказалось, что число положительной валентности определяется числом электронов в недостроенной внешней оболочке, а отрицательной - числом электронов, недостающих до заполнения внешней оболочки, чтобы она имела электронную структуру ближайшего по периоду в Менделеевской системе инертного газа. [12]
В табл. II ( в приложении) этими символами указаны электронные конфигурации всех элементов. Как видно из этой таблицы, особое положение инертных газов среди химических элементов связано с тем, что в атоме инертного газа каждый раз заканчивается заполнение внешней оболочки, а с атома каждого следующего за инертным газом элемента начинается заполнение новой оболочки. [13]
В табл. 2 ( в приложении) этими символами указаны электронные конфигурации всех элементов. Как видно из этой таблицы, особое положение инертных газов среди химических элементов связано с тем, что в атоме инертного газа каждый раз заканчивается заполнение внешней оболочки, а с атома каждого следующего за инертным газом элемента начинается заполнение новой оболочки. [14]
Поведение элементов III группы хорошо объясняется строением электронной оболочки атомов. Заполнение внешней оболочки пятью электронами с образованием отрицательного иона, имеющего электронную конфигурацию ближайшего в периодической таблице инертного газа, невозможно, поскольку заряд ядра недостаточен для связывания такого большого числа электронов. Поэтому алюминий и остальные элементы III группы образуют преимущественно положительные трехвалентные ионы и, следовательно, обладают металлическим характером. Вследствие своего сравнительно малого объема и большого заряда ион алюминия сильно гидратирован. [15]
Страницы: 1 2