0-связь
Cтраница 1
Образование 0-связей обусловлено участием одного валентного электрона от каждого атома С и N, причем каждый атом С и N, за исключением атомов углерода метальных групп, образует по три о-связи. Остальные шесть я-электронов ( включая неподеленную пару р-электронов атома азота) находятся в поле молекулярных остовов положительно заряженных атомов углерода и азота. Таким образом в молекуле красителя, так же как и в куске металла, я-электрон можно рассматривать, как если бы он находится в одномерном потенциальном ящике, стенки которого были бы бесконечно высоки. Длина цеп молекулы красителя, в качестве модели которой можно взять молекулу полиена, равна длине ящика L Nl, где / - длина звена НС СН - СН, N - число звеньев в цепочке, равное числу пар подвижных я-элект-ронов. [1]
 |
Схема расположения 0-связей ( а и л-связей ( б в молекуле этилена. [2] |
Наличие слабо полярных ковалентных 0-связей обусловливает относительную инертность алканов. [3]
 |
Структура графита. [4] |
В образовании 0-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешнего слоя занимает 5 -орбиталь, не участвующую в гибридизации. [5]
 |
Структура графита. [6] |
В образовании 0-связей участвуют три электрона каждого атома углерода. Четвертый электрон внешнего слоя занимает 2р - орбиталь, не участвующую в гибридизации. [7]
Общее число 0-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу о-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно -, ди - и более дентатные лиганды. [8]
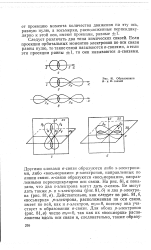 |
Образование Л - и О - связей. [9] |
Другими словами 0-связи образуются либо s - электрона-ми, либо восьмерками р-электронов, направленных по линии связи, я-связи образуются восьмерками, направленными перпендикулярно оси связи. На рис. 81, а показано, что два s - злектрона могут дать сг-связь. Действительно, как следует из рис. 81 6, восьмерка р-электрона, расположенная по оси связи, имеет по ней, как и s - электрон, т 0, поэтому она участвует в образовании сг-связи. [10]
При рассмотрении 0-связей мы предполагали, что существует аксиальная симметрия относительно направления связи. Это означает, что вращение находящихся на концах связи двух групп одной относительно другой не встречает сопротивления, как впервые было постулировано Вант-Гоффом. В этом отношении имеется резкое различие между а - и л-связями, ибо ( см. раздел 8.2) уменьшение перекрывания я-орбиталей двойной связи при непараллельном их положении приводит к ослаблению связи; отсюда следует, что для вращения одного конца относительно другого вокруг оси связи требуется совершить работу. К а-связям это не относится, и можно ожидать свободного вращения вокруг связей. [11]
 |
Схема, показывающая образование химических связей в молекуле N2.| Строение молекулы С2Н6. [12] |
Электронное облако 0-связи, расположенное вдоль оси, соединяющей центры атомов, имеет цилиндрическую симметрию относительно этой оси. Поворот одного из атомов вокруг данной оси не изменит распределения электронной плотности в cr - связи и, следовательно, его можно осуществить, не разрывая и не деформируя данную связь. Изложенное объясняет давно известный химикам факт возможности свободного вращения атомов вокруг связи С-С, обусловливающий отсутствие цис - транс-изомерии у производных этана и других органических соединений с одинарной связью между атомами углерода. [13]
В образовании 0-связей с атомами хлора и кислорода в молекуле SOC12 участвуют три р-электрона атома серы, следовательно, молекула SOC12 имеет пирамидальную структуру. [14]
Полярная природа 0-связи в ДМСО определяет высокую сольватирующую способность Этого растворителя по отношению к веществам ионной структуры, вследствие чего многие неорганические реагенты обладают заметной растворимостью в ДМСО. При этом особенно сильным является взаимодействие катионов растворенного вещества и стерически доступного атома кислорода ДМСО, несущего частичный отрицательный заряд. Анионы меньше сольватируются в ДМСО, чем в протонных растворителях, поскольку в ДМСО отсутствуют протоны, способные к образованию водородных связей с анионными частицами, а положительно заряженный атом серы стерически менее доступен, чем атом кислорода. Пониженная сольватация анионов в ДМСО ( и в других диполярных апротонных растворителях) приводит к тому, что активность этих частиц в ДМСО в ряде важнейших реакций, таких, как реакции типа S 2 и отрыв протона, резко возрастает, по сравнению с их активлостью в растворителях, образующих водородные связи. [15]
Страницы: 1 2 3 4 5