0-связь
Cтраница 2
Переориентация электронов 0-связи и неподеленной пары является основной характеристикой реакции. Отсюда следует, что базисные конфигурации должны включать конфигурацию без связи, однократно возбужденную и двукратно возбужденную конфигурации, затрагивающие два я-электрона СН2СН2, два а-электрона HF и подходящую неподеленную пару электронов F. [16]
Наряду с простыми 0-связями между атомами кремния и кислорода возникают еще и я-связи, образующиеся по донорно-акцептор-ному механизму за счет свободных d - орбиталей атомов кремния и неподеленных 2 / 7-электронных пар атомов кислорода. В результате образуется не молекулярная, как в кристалле диоксида углерода, а атомная решетка. [17]
Предположим, что 0-связь С1 - С образуется из Зр2 - АО хлора. [18]
В органических соединениях 0-связи встречаются наиболее часто. Между атомами первой образуется а-связь. В структурных формулах она обозначается одной черточкой, например С-С. Если создаются условия для образования второй связи между атомами, то ею может быть только я-связь. Обе связи в формулах обозначаются черточками, например СС. Третья связь тоже может быть только я-связью. [19]
Значения интегралов перекрывания 0-связей в этом ряду монотонно уменьшаются, что говорит об уменьшении степени ковалентности связи элемент - кислород и, следовательно, о возрастании электронной плотности на кислороде. [20]
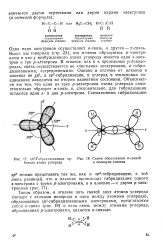 |
Схема образования я-связей в молекуле этилена. [21] |
Одна napq электронов осуществляет 0-связь, а другая - л-связь. [22]
Каждая группа CCPh образует 0-связь с одним атомом меди, симметрично я-связана с другим и несимметрично я-связана с третьим атомом меди. [23]
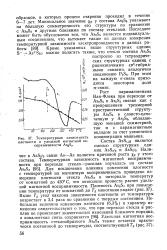 |
Температурная зависимость плотности и удельной магнитной восприимчивости. [24] |
При этом на каждую 0-связь приходится некоторая доля я-связи. [25]
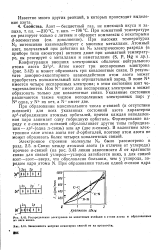 |
Распределение электронов по квантовым ячейкам в атоме азота И образованных из него ионах. [26] |
При образовании максимального числа 0-связей ( и отсутствии гс-связей) для всех указанных состояний азота характерна 5р3 - гибридизация атомных орбиталей, причем каждая неподеленная пара занимает одну гибридную орбиталь. В валентном электронном слое атома азота нет d - орбиталей, поэтому атом азота не может образовать более четырех ковалентных связей. [27]
Перенос заряда при образовании 0-связи М - СО и я-связи М - СО приводит к уменьшению порядка связи в молекуле СО. [28]
Во многих комплексах алкенов 0-связи металл - углерод отсутствуют. Такие комплексы получают, например, обработкой безводного хлорида или бромида Pt ( IV) непредельными органическими соединениями в безводных растворителях. [29]
При квантовомеханическом описании три 0-связи метильной группы или, что эквивалентно для наших целей, три ls - орбитали водорода рассматриваются как набор, из которого можно сконструировать три групповые орбитали ( рис. С. Комбинация этих трех орбиталей с одинаковыми фазами образует орбиталь, охватывающую все три атома и имеющую цилиндрическую симметрию относительно направления связи С-С, поэтому она не дает никакого результирующего перекрывания с ароматической я-системой. [30]
Страницы: 1 2 3 4 5