Электронная заселенность
Cтраница 3
Только в этих случаях заселяются электронами также и вышележащие по энергии б-связывающие молекулярные орбитали м-м, единственно ответственные за возникновение м-м-связей. При этом и в случае карбонильных кластеров, так же, как и хлоридных, оптимальная ( относительно энергетической стабильности) электронная заселенность связана, очевидно, с заполнением только связывающих и вакантностью разрыхляющих молекулярных орби-талей металл-металл. [31]
Они достаточно наглядно иллюстрируют характер изменений в распределении электронной плотности при комплексообразовании. Из сопоставления приведенных данных можно заключить, что межмолекулярная связь В-N в комплексе является в основном 0-связью. Суммарная электронная заселенность ВН3 и NH3 в комплексе составляет 8 25 и 9 75 соответственно. Следовательно, при комплексообразовании от NH3 к ВН3 переносится - 0 25 электрона. [32]
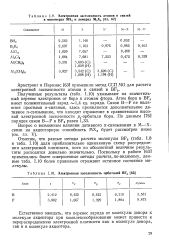 |
Электронная заселенность атомов и связей в мономерах МХ3 и димерах М2Хе.| Электронная заселенность орбиталей BF3. [33] |
Полученные результаты ( табл. 1.10) указывают на значительный перенос электронов от бора к атомам фтора. Атом бора в BF3 имеет положительный заряд - 1 4 ед. Связи В-F не являются простыми сг-связями, здесь проявляется дополнительное дативное я-связывание, что находит отражение в сравнительно высокой электронной заселенности рг-орбитали бора. [34]
К этому важному выводу первоначально пришли Коттон в laac [9], которые рассмотрел. Но полученные в нашей работе результаты позволяют дать еще одну в, как нам кажется, более тонкую и строгую модификацию общего решения проблемы энергетической устойчивости кластеров. При этом такая зависимо - - сть всегда оказывается экстремальной, и наибольшее значение энергии связывания при всех значениях варьируемых параметров ji, Hdd RM-M достигается прв оптимальной электронной заселенности металлических молекулярных орбиталей М - группы и, стало быть, всего кластера в целом. Небезынтересно подчеркнуть, что величины энергии металл-металл взаимодействий, рассчитанные для каждой формы кластерной группировки как частное от деления наибольшего значения анергии связывания на число атомов металла в кластере и на соответствующее этому наибольшему занчению энергн. [35]
Энергетические состояния, составляющие зону, можно считать аналогами молекулярных орбиталей, простирающихся по всему кристаллу. Каждая молекулярная орбиталь аппроксимируется как результат перекрывания атомных волновых функций от всех атомов. Общее число состояний, принадлежащих данной зоне, равно числу атомов, вносящих свои вклады. Например, d - полосы ( обусловленные атомными d - функциями) обычно уже, чем р - или s - зоны с таким же главным квантовым числом. В любом случае электронная заселенность зоны ограничивается 2N, где N - число атомных орбиталей. [36]
Кларк и Сканлан [49] провели наиболее полный расчет ab initio по методу ЛКАО МО ССП строения и реакционной способности пиридина C5H5N, фосфорина С5Н5Р и арсабензола C5H5As с использованием экспериментальных данных [50] для пиридина и [40] для фосфорина. Введение 3 -функций фосфора понижает энергию системы фосфорина ( - 526 ат. В ряду пиридин-фосфо-рин-арсабензол наблюдается вместе с тем уменьшение а-элект-ронной плостности на гетероатоме, что объясняется различием в электроотрицательностях N, Р и As. Валентная л-электронная плотность у гете-роатома падает в неожиданной последовательности AsNP, а электронная заселенность на атомах углерода в фосфорине и арсабензоле следует порядку Ср ( мета) - Cv ( пара) Са ( орто), противоположному наблюдаемому в пиридине. [37]
При попытках построения упрощенных, по замыслу, физических моделей внутримолекулярных взаимодействий наряду с такими понятиями как полярность и поляризуемость ковалент-ных связей, а так же атомные заряды, часто привлекают еще понятие электроотрицательности элементов [ 2, с. Несомненно, например, что каждому из элементов не может быть приписано какое-то одно значение электроотрицательности по Паулингу [2] или по. То же самое относится и к каждой определенной орбитали любого конкретного спектроскопического или валентного состояния того или иного атома. Высказана [16-19] идея ( см. также [20-26]), согласно которой орбитальная электроотрицательность есть параболическая функция от электронной заселенности рассматриваемой орбитали. К сожалению, в указанных работах подход к проблеме слишком формален, поскольку авторы не ставили в явном виде вопроса о причине зависимости орбитальной электроотрицательности от электронной заселенности. [38]
При попытках построения упрощенных, по замыслу, физических моделей внутримолекулярных взаимодействий наряду с такими понятиями как полярность и поляризуемость ковалент-ных связей, а так же атомные заряды, часто привлекают еще понятие электроотрицательности элементов [ 2, с. Несомненно, например, что каждому из элементов не может быть приписано какое-то одно значение электроотрицательности по Паулингу [2] или по. То же самое относится и к каждой определенной орбитали любого конкретного спектроскопического или валентного состояния того или иного атома. Высказана [16-19] идея ( см. также [20-26]), согласно которой орбитальная электроотрицательность есть параболическая функция от электронной заселенности рассматриваемой орбитали. К сожалению, в указанных работах подход к проблеме слишком формален, поскольку авторы не ставили в явном виде вопроса о причине зависимости орбитальной электроотрицательности от электронной заселенности. [39]
Страницы: 1 2 3