Пропанол
Cтраница 2
Хлор-1 - пропанол, пропиленхлоргидрин, р-хлорпропиловый спирт, С3Н7ОС1, легковоспламеняющаяся жидкость. [16]
Диметиламин-2 - пропанол, 2 - ( диметиламин) - этанол, 2 - ( диэтиламин) - метанол, 2 - ( метиламин) - этанол и фенилэтиламин элюируются в указанном порядке. Наименьшее количество диметиламиноэтанола, определяемое ТК-ячейкой при наибольшей ее чувствительности, составляет 0 1 - 0 5 мкг. В другой работе [51] это соединение анализировали с помощью ионизационного детектора, используя в качестве газа-носителя аргон. [17]
Диметил-1 - пропанол - первичный спирт, однако из-за пространственных трудностей он реагирует по 5дг1 - механизму. Образующийся первичный карбкатион быстро изомери-зуется в более устойчивый третичный карбкатион, что и определяет конечный результат реакции. [18]
В спектре пропанола, адсорбированного при температурах ниже 148 С, наблюдаются полосы поглощения при 1160, 1131 и 1114 см 1, приписываемые скелетным колебаниям изопропильной группы. Полоса при 1378 см 1 соответствует колебаниям СН3 - группы, а полоса при 1312 см-1 - колебаниям групп СОН. Кроме того, при 3690 см 1 наблюдается полоса поглощения ОН-групп. [19]
При гидрировании пропанола и бутанола в слое адсорбированного водорода ( опыты 1 и 6 в табл. 1), несмотря на разрыв Ci - С2 - связи, метан в заметных количествах не образуется. По-видимому, можно предположить либо образование в растворе метанола, либо хемосорбцию на поверхности электрода частицы, включающей Ci-атом, например HCjO, что кажется более вероятным. [20]
Основная масса пропанола, а также диизобутилового п бутил-изобутилового эфиров концентрируется в промежуточной фракции 80 - 106 С, дибутилового эфира - во фракции 108 - 116 С. [21]
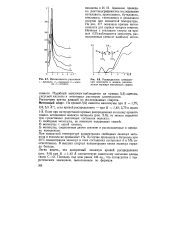 |
Интенсивность рассеяния. / - бутанола. 2 - пропанола. 3 - г ла. 4 - метанола.| Распределение электронной плотности и модель располо-метилового спирта. [22] |
В случае пропанола и бутанола при 20 С концентрация молекул в этих состояниях составляет 4 и 5 % соответственно. [23]
Такой реакцией окисляют пропанол в ацетон, глицерин - в диоксиацетон, молочную кислоту - в пировиноградную; кроме того, соединения типа углеводов, например маннит - во фруктозу, сорбит - в сорбозу, а также вещества из важнейшей группы циклических соединений - гормонов, в основе структуры которых лежит циклопентанпергидрофенантрен. [24]
Объясните, почему пропанол образует межмолекулярные водородные связи, а пропаналь - нет. [25]
Описано [25] окисление пропанола кислородом воздуха в присутствии солей меди, никеля и кобальта. С окисью меди возможно дегидрирование пропанола в пропионовый альдегид и окисление в пропионовук кислоту с 90 % выходом. [26]
Теплота сгорания паров пропанола - 2064 0 кДж / моль. Вычислить теплоту сгорания жидкого пропанола, если теплота его испарения составляет от 41 84 до 48 12 кДж / моль. [27]
Теплота сгорания паров пропанола - 2064 0 кдж / моль. Вычислить теплоту сгорания жидкого пропанола, если теплота его испарения составляет от 41 84 до 48 12 кдж / моль. [28]
Наиболее пригодными растворителями являются пропанол или слегка подогретый ( до 37) этанол. Прежде чем пытаться растворить полисаха-ридный комплекс в органических растворителях, его нужно отмыть от неорганических солей. Полисахарид осаждают, прибавляя к раствору неорганическую соль. Лучше использовать спиртовой или очень концентрированный водный раствор соли, чтобы сохранить максимальной концентрацию органического растворителя. Наиболее удобными неорганическими электролитами являются ацетат натрия, йодистый натрий, тиоциа-нат натрия и хлористый кальций. Получаемый полисахарид представляет собой соль неорганического катиона. [29]
В качестве осадителя применяют пропанол, а затем пленку промывают водой. [30]
Страницы: 1 2 3 4