Протелин
Cтраница 2
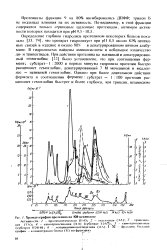 |
Хроматография протелина на КМ-целлюло. 1с. [16] |
Определение глубины гидролиза иротелином некоторых белков показало [33, 74], что препарат гидролизует при рН 8 5 около 83 % пептидных связей в казеине и около 80 % в денатурированном яичном альбумине. В гидролизатах найдены аминокислоты и небольшое количество ди - и трипентидов. При действии протелина на иативный и денатурированный гемоглобин [22] было установлено, что при соотношении фермент; субстрат-1: 2000 в первые минуты гидролиза протелин быстро расщепляет гемоглобин, денатурированный 7 М мочевиной и медленнее - нативный гемоглобин. [17]
Протелин, подобно проназе, расщепляет проколлаген из шкуры теленка. Действие протелина на проколлаген значительно глубже действия трипсина. При отношении фермент: субстрат 1: 10, температуре 30 и продолжительности протеолиза 24 часа протелин расщепляет в монрмере коллагена ( молекулярный вес 260000) 21 пептидную связь, в то время как трипсин гидролизует только три связи. [18]
Для ферментов фракций I-IV характерна в основном протеолитическая активность; это металлоферменты, ингибируемые на 100 % трилоном Б и нуждающиеся в ионах кальция для проявления активности и стабилизации фермента. Более 90 % лейцинами-нопептидазной активности равномерно распределено по фракциям IV - VIII. Во фракциях VII, VIII по действию на специфические субстраты найдено 89 % всего количества трипсина протелина, 35 % - химотрипсина и 20 % эластазы протелина. Трипсин протелина по удельной активности близок к таковой Панкреатического трипсина. [19]
Протеолитическая активность довольно четко выражена у большого числа видов и штаммов актиномицетов. Однако протеолитические ферменты актиномицетов привлекли внимание исследователей только в 50 - е годы, после того, как эти микроорганизмы стали культивировать с целью получения антибиотиков. Несколько позднее были разработаны методы раздельного выделения продуктов биосинтеза и получены такие препараты, как проназа и протелин из Streptomyces griseus и римопротелин из Act. [20]
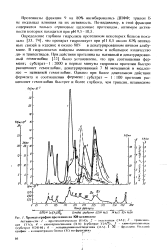 |
Хроматография протелина на КМ-целлюло. 1с. [21] |
Определение глубины гидролиза иротелином некоторых белков показало [33, 74], что препарат гидролизует при рН 8 5 около 83 % пептидных связей в казеине и около 80 % в денатурированном яичном альбумине. В гидролизатах найдены аминокислоты и небольшое количество ди - и трипентидов. При действии протелина на иативный и денатурированный гемоглобин [22] было установлено, что при соотношении фермент; субстрат-1: 2000 в первые минуты гидролиза протелин быстро расщепляет гемоглобин, денатурированный 7 М мочевиной и медленнее - нативный гемоглобин. [22]
Для ферментов фракций I-IV характерна в основном протеолитическая активность; это металлоферменты, ингибируемые на 100 % трилоном Б и нуждающиеся в ионах кальция для проявления активности и стабилизации фермента. Более 90 % лейцинами-нопептидазной активности равномерно распределено по фракциям IV - VIII. Во фракциях VII, VIII по действию на специфические субстраты найдено 89 % всего количества трипсина протелина, 35 % - химотрипсина и 20 % эластазы протелина. Трипсин протелина по удельной активности близок к таковой Панкреатического трипсина. [23]
Протелин, проназа и протеазы Actinomyces 771 гидролизуют многие глобулярные и некоторые фибриллярные белки. Гидролиз идет преимущественно до аминокислот, содержание которых в гидролизатах достигает 70 - 80 % от количества белка, взятого для исследования. Протофрадин гидролизует в различных белках 36 - 65 % пептидных связей, но основными продуктами гидролиза являются олигопептиды, а количество аминокислот не превышает 30 - 35 %, что заметно отличает проюфрадин от протелина и других препаратов и, по-видимому, свидетельствует о малой активности содержащихся в протофрадине пептидаз. [24]
В связи с применением протеолитических ферментов для обезволаши-вания и мягчения кожевенных полуфабрикатов исследовано действие протелина [27] на неколлагеновые компоненты кожного покрова животных. Эти исследования показали, что протелин гидролизует мукопо-лисахариды, выделенные из парной шкуры теленка. Глубина протеолиза зависит от величины соотношения фермент: субстрат, продолжительности протеолиза и температуры. Протелин гидролизовал мукополисаха-ридный комплекс значительно глубже, чем трипсин, под влиянием которого при 38 разрывалось не более 29 % пептидных связей. [25]
Для ферментов фракций I-IV характерна в основном протеолитическая активность; это металлоферменты, ингибируемые на 100 % трилоном Б и нуждающиеся в ионах кальция для проявления активности и стабилизации фермента. Более 90 % лейцинами-нопептидазной активности равномерно распределено по фракциям IV - VIII. Во фракциях VII, VIII по действию на специфические субстраты найдено 89 % всего количества трипсина протелина, 35 % - химотрипсина и 20 % эластазы протелина. Трипсин протелина по удельной активности близок к таковой Панкреатического трипсина. [26]
Протофрадин гидролизует в белках 35 5 - 64 5 % общего числа пептидных связей. В процессе гидролиза образуются преимущественно олиго-пептиды, содержащие от двух до шести аминокислотных остатков. Количество свободных аминокислот в гидролизатах не превышает 30 % от содержания их в белках, взятых для исследования. Таким образом, протофрадин, по-видимому, по гидролитической способности отличается от проназы и протелина, которые гидролизуют белки главным образом до свободных аминокислот. Однако необходимо учитывать, что непосредственное сопоставление полученных экспериментальных данных вряд ли возможно, так как условия проведения протеолиза в этих опытах были не идентичны. [27]
Страницы: 1 2