Протонирование - анион
Cтраница 2
Растворимость осадков, катионы и анионы которых одновременно участвуют в сопряженных протолитнческих реакциях, зависит от рН насыщенного раствора. В кислых растворах с уменьшением рН увел-ичивается протонирование аниона, и растворимость осадка возрастает; в щелочных растворах с повышением рН растворимость осадков также увеличивается вследствие образования растворимых гидроксбкомплексов. [16]
В некоторых случаях были получены два различных стереоизомерных продукта [ 10а ], но в большинстве случаев, когда принципиально могли получиться диастерео -: изомеры, выделялся только один из них. Атака р-углеродного атома протекает перпендикулярно к плоскости двойной связи [95], и обычно вслед за ней немедленно происходит протонирование получившегося аниона. [17]
В некоторых случаях были получены два различных стереоизомерных продукта [ 10а ], но в большинстве случаев, когда принципиально могли получиться диастерео-изомеры, выделялся только один из них. Атака fj - углеродного атома протекает перпендикулярно к плоскости двойной связи [95], и обычно вслед за ней немедленно происходит протонирование получившегося аниона. [18]
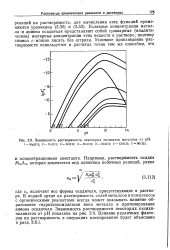 |
Зависимость растворимости некоторых оксинатов металлов от рН. V-Mg ( II. 2 - Са ( П. 3 - Sr ( II. 4 - Ва ( И. 5 - Zn ( II. ff - Cu ( II. 7 - Ni ( II. [19] |
А включает осе формы осадителя, присутствующие в растворе. В водной среде на растворимость солей металлов и комплексов с органическими реагентами всегда может оказывать влияние образование гидроксокомплексов иона Металла и протонирование аниона осадителя. Зависимость растворимости некоторых оксихи-нолинатов от рН показана на рис. 3.9. Влияние различных факторов на растворимость в операциях маскирования будет объяснено в разд. [20]
В водном растворе полупернод установления этого равновесия составляет 10 мин. Кислотность, выражаемая константой равновесия, достигает рКа 2 50 в воде и 5 20 в метаноле. Это объясняется большей дело-кализацией заряда и, следовательно, меньшей скоростью протонирования аниона. Если сравнить СН-кнслотность ( рКа) обычных нитросоединений - MeNO2 ( 10 28), PhCH2NO2 ( 6 77), CH2 ( NO2) 2 ( 3 57), HC ( NO2) 3 ( 0 14), то увидим, что только тринитрометан имеет превосходство по кислотности. [21]
В водном растворе полупернод установления этого равновесия составляет 10 мин. Кислотность, выражаемая константой равновесия, достигает рКа 2 50 в воде и 5 20 в метаноле. Это объясняется большей дело-кализацией заряда и, следовательно, меньшей скоростью протонирования аниона. Если сравнить СН-кнслотность ( рКа) обычных нитросоединений - MeNO2 ( 10 28), PhCH2NO2 ( 6 77), CH2 ( NQ2) 2 ( 3 57), HC ( NO2) 3 ( 0 14), то увидим, что только тринитрометан имеет превосходство по кислотности. [22]
В водном растворе полупернод установления этого равновесия составляет 10 мин. Кислотность, выражаемая константой равновесия, достигает рКа 2 50 в воде и 5 20 в метаноле. Это объясняется большей дело-кализацией заряда и, следовательно, меньшей скоростью протонирования аниона. Если сравнить СН-кнслотность ( рКа) обычных нитросоединений - MeNO2 ( 10 28), PhCH2NO2 ( 6 77), CH2 ( NO2) 2 ( 3 57), HC ( NO2) 3 ( 0 14), то увидим, что только тринитрометан имеет превосходство по кислотности. [23]
Механизм этой реакции подобен сложноэфирной конденсации Кляйзена ( гл. Анион ДМСО ( димсиланион) первоначально присоединяется по карбонильной группе сложного эфира с образованием анионного тетраэдрического интермедиата. Этот интермедиат стабилизируется в результате отщепления этилат-иона с образованием 1 3-кетосулъфоксида. Второй эквивалент димсиланиоиа переводит их в сопряженный анион, протонирование аниона с помощью минеральной кислоты регенерирует 1 3-кетосульфоксид. [24]
Страницы: 1 2