Процесс - достижение - равновесие
Cтраница 2
Рассуждая в целом в духе Маршалла, Кондратьев внес два суш ственных новшества: использовал статистике-вероятностны и подх к определению понятия равновесия и признал важность сжидаии; процессе достижения равновесия. Он отказался от вальрасианско процесса определения равновесных цен, прежде всего от предпось ки о том, что аукционист определяет равновесные цены и сообща их участникам обмена, тем самым ставя их в условия полного: зн ния. Именно предпосылка о совершенном знании экономическ субъектов была, по мнению Кондратьева, самой слабой стороной i ории равновесия Вальраса. И сегодня эта оценка является обшепр нятой. Наконец, Кондратьев подошел к вопросу об устойчивости ра новесия, в связи с чем ввел понятие нейтрального ( по современи терминологии, а у Кондратьева - безразличного) статического ра новесия. Суть этого понятия в том, что в случае изменения внешн условий система придет в новое состояние равновесия, в котор будет пребывать до нового возмущения. [16]
 |
Пример гетероген - - - ных физико-химических систем - трехфазной ( а и четырехфазной ( б. 2. [17] |
Фазой называется гомогенная часть системы, находящаяся в одном и том же агрегатном и модификационном состоянии И обладающая одинаковыми параметрами или параметрами, которые могут стать тождественными при их непрерывном изменении в процессе достижения равновесия. [18]
Концентрации МПАВ в истинном растворе выше ККМ соответствуют пересыщенному раствору, причем снижение пересыщения путем выделения мицелл почти одинакового размера происходят весьма быстро. Кинетика процесса достижения равновесия до настоящего времени не изучена. [19]
Концентрации МПАВ в истинном растворе выше ККМ соответствуют пересыщенному раствору, причем снижение пересыщения путем выделения мицелл почти одинакового размера происходит весьма быстро. Кинетика процесса достижения равновесия до настоящего времени не изучена. [20]
Необходимо подчеркнуть, что приведенные выше сведения относятся только к равновесным условиям, которые, хотя и быстро устанавливаются на поверхности жидкости, в условиях верхней зоны больших резервуаров достигаются лишь после многих часов или даже суток. В промежуточные периоды процесса достижения равновесия могут существовать взрывоопасные смеси. [21]
Недавно было показано, что быстродействующие электронные счетные машины можно использовать для получения интересной и полезной информации о движении большого количества взаимодействующих частиц. Их результаты показывают в наиболее наглядной форме процесс достижения равновесия. [22]
Такой продукт называют кинетически контролируемым. Однако если реакции обратимы, соотношение продуктов может быть и иным. Если остановить процесс задолго-до достижения равновесия, реакция будет кинетически контролируемой, так как в смеси присутствует больше того продукта, который образуется быстрее. [23]
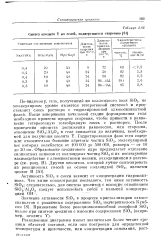 |
Синтез цеолита Y из гелей, подвергшихся старению. [24] |
По-видимому, гель, полученный из коллоидного золя Si02, на молекулярном уровне является гетерогенной системой и представляет смесь раствора с гидратированной алюмосиликатной фазой. После завершения начальной стадии формирования геля необходимо провести процесс старения, чтобы привести в равновесие гетерогенную гелеобразную смесь с раствором. После проведения процесса достижения равновесия, или старения, отношение Si02 / Al20g в геле снижается до величины, необходимой для получения цеолита Y. Гидратировапиая фаза геля содержит относительно большие агрегаты частиц Si02, молекулярный вес которых колеблется от 100 000 до 500 000, размеры - от 10 до 20 нм. Образование цеолитового ядра предполагает отделение силикатных анионов от коллоидных частиц Si02 и их последующее взаимодействие с алюминатными ионами, находящимися в растворе ( см. разд. [25]
Низкомолекулярное вещество при данной температуре может находиться в одном из трех физических ( агрегатных) состояний: твердом, жидком или газообразном. При изменении температуры происходит перегруппировка молекул и вещество из одного равновесного состояния переходит в другое. Этот переход требует определенного времени. Процесс достижения равновесия во времени называется релаксацией, а время достижения равновесия - временем релаксации. У низкомолекулярных соединений время релаксации очень мало и практически не оказывает влияния на поведение вещества. [26]
Первоначальное резкое повышение п обусловлено интенсивным образованием УМЭ. Последующее ее медленное разрушение ( коалесценция), сопровождающееся укрупнением капель и уменьшением их числа, приводит к снижению п вплоть до достижения наименьшего равновесного значения ( правн), отвечающего пределу солюбилизации. Таким образом, для получения достоверных данных о солюбилизации в этом случае необходимо измерять тот равновесный предельный показатель преломления водной фазы, который устанавливается при полном расслоении эмульсии. Процесс достижения равновесия ( в статических условиях) - требует нескольких суток, а в некоторых случаях - более месяца. Для ускорения разрушения и расслоения эмульсии удобно применять центрифугирование образцов. [27]
Если маскированием не удается создать условия, при которых взаимодействие определяемого вещества с реагентом было бы специфическим, мешающие компоненты до выполнения анализа необходимо отделить. Для этой цели используют различия в поведении веществ либо в равновесном состоянии, либо во время процесса, ведущего к равновесному состоянию. Равновесия описываются термодинамикой, поэтому равновесные методы разделения называют также термодинамическими. Процессы достижения равновесия изучаются химической кинетикой и соответствующие методы разделения называют кинетическими. [28]
Стадия синтеза состоит, в конечном счете, в выдержке смеси окислов, полученной тем или иным путем при определенной температуре. При достаточно длительной выдержке можно достигнуть равновесного состояния синтезируемого феррита, которое не зависит от пути, по которому пришли к этому состоянию. Однако в реальном производстве такого равновесного состояния достигнуть не удается, а стремится к нему путем увеличения выдержки нерационально, так как процесс достижения равновесия медленный и затраты на его проведение повысят себестоимость продукции. [29]
Страницы: 1 2