Процесс - изменение - состояние - система
Cтраница 2
Количественное исследование зависимости объема газа от температуры при неизменном давлении было осуществлено Гей-Люссаком. Процесс изменения состояния системы при постоянном давлении называют изобарным. Опыты показали, что изменение объема газа происходит пропорционально приращению температуры. [16]
Изменение состояния термодинамической системы, связанное с изменением ее параметров, называется термодинамическим процессом. Процесс изменения состояния системы может быть равновесным и неравновесным. [17]
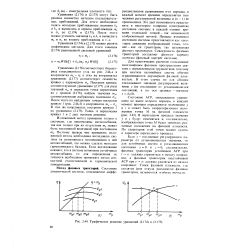 |
Графическое решение уравнений и. [18] |
Это дает возможность представить в некотором n - мерном пространстве состояние системы в каждый момент времени отдельной точкой - так называемой изображающей точкой. Процесс изменения состояния системы представляется как некоторое движение изображающей точки, точнее - как ее траектория, так называемая фазовая траектория. [19]
Множество точек, изображающих начальные возможные состояния системы, образуют n - мерное фазовое пространство этой системы. Каждому процессу изменения состояния системы во времени соответствует движение той фазы ( точки), которая в начальный момент времени изображала начальное состояние системы. Траектория, прочерчиваемая этой фазой на фазовой плоскости, называется фазовой траекторией. Неизменному состоянию системы соответствует точка ( одноточечная траектория), называемая точкой покоя на плоскости. [20]
В предельном случае, когда внешние условия меняются очень медленно, можно считать, что при соответствующем медленном изменении параметров системы каждое ее промежуточное состояние является равновесным. При этом сам процесс изменения состояния системы называется равновесным. Напротив, если при изменении внешних условий меняющиеся состояния системы не являются равновесными, то процесс называется неравновесным. При изменении внешних условий параметры состояния системы стремятся к равновесным значениям, соответствующим меняющимся внешним условиям. [21]
Для методологии Ульриха характерен отказ от статического анализа социальных явлений. Внимание разработчиков концентрируется на динамике процесса изменения состояния системы, прогнозировании возможных последствий. [22]
Прежде всего, рассмотрим первые два вопроса, а именно докажем, что обобщение основного уравнения термодинамики на процессы, заключающиеся в изменении массы и состава системы, является законным, и попутно докажем, что химический потенциал действительно играет роль обобщенной химической силы, если химический потенциал взять со знаком минус. Для указанной цели мы сначала рассмотрим процесс изменения состояния системы при неизменности масс компонентов, обозначая изменения величин, относящихся к этому процессу, одним штрихом, а затем рассмотрим процесс изменения массы и состава системы при неизменном состоянии, обозначая изменение величин, относящихся к этому процессу, двумя штрихами. [23]
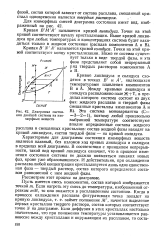 |
Диаграмма состояния двойной системы из изоморфных веществ. [24] |
Характерным для диаграммы состояния изоморфных веществ является плавный, без изломов ход кривых ликвидуса и солидуса в пределах всей диаграммы. В соответствии с принципом непрерывности, такой вид кривой ликвидуса означает, что в процессе изменения состояния системы не должно появляться никаких новых фаз, кроме уже образовавшихся. И действительно, при охлаждении расплава любой концентрации кристаллизуется лишь одна единственная фаза - твердый раствор, состав которого определяется составом равновесной с ним жидкой фазы. Рассмотрим этот процесс на диаграмме. [25]
 |
Диаграмма состояния двойной системы из изоморфных веществ. [26] |
Для диаграммы состояния изоморфных веществ характерен плавный, без изломов ход кривых ликвидуса и солидуса в пределах всей диаграммы. В соответствии с принципом непрерывности, такой вид кривой ликвидуса означает, что в процессе изменения состояния системы не должно появляться никаких новых фаз, кроме уже образовавшихся. И действительно, при охлаждении расплава любой концентрации кристаллизуется лишь одна единственная фаза - твердый раствор, состав которого определяется составом равновесной с ним жидкой фазы. [27]
Необходимо отметить существенное различие свойств величин U, Q и L. Uz - t / i - Величины Qj 2 и Ll 2 означают количества тепла и работы, которыми система обменивается с окружающей средой при переходе из состояния 1 в состояние 2, и поэтому эти величины зависят от условий, при которых совершается процесс изменения состояния системы. [28]
Допустим, что мы выбрали в n - мерном пространстве систему координат, по осям которой будем откладывать значение регулируемой величины и ее ( п - 1) производных. Трчка в такой системе координат определяет состояние системы автоматического регулирования и носит название изображающей точки. Процесс изменения состояния системы представится как некоторое движение изображающей точки, точнее ее траекторией, которая называется фазовой траекторией. Начальные условия системы определяют начальное положение изображающей точки в фазовом пространстве, под которым понимается указанное - мерное пространство. [29]
Все части внутренней энергии зависят от того, в каком состоянии находится система. Внутренняя энергия определяется термодинамическим состоянием системы и не зависит от того, каким образом система оказалась в данном состоянии. Следовательно, внутренняя энергия не связана с процессом изменения состояния системы. [30]
Страницы: 1 2 3