Процесс - электрохимическая коррозия - металл
Cтраница 1
Процесс электрохимической коррозии металла в растворе электролита возможен в том случае, если на его поверхности имеются анодные и катодные участки, отличающиеся величиной электродного потенциала. Разность потенциалов катода и анода выражает количественно степень электрохимической неоднородности двух участков поверхности. [1]
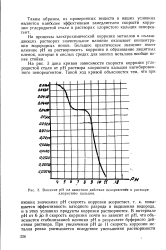 |
Влияние рН на защитное действие пенореаген з в растворе хлористого кальция. [2] |
На процессы электрохимической коррозии металлов в охлаждающих растворах значительное влияние оказывает концентрация водородных ионов. Большое практическое значение имеет влияние рН на растворимость коррозии и образование защитных пленок, которые в кислых средах для многих металлов вообще менее стойки. [3]
Принципиальная возможность протекания процесса электрохимической коррозии металла определяется, таким образом, соотношением обратимого потенциала металла в данных условиях и обратимого потенциала катодного процесса в данных условиях. [4]
Скорость н характер процесса электрохимической коррозии металлов зависят от многих факторов, которые подразделяются па внутренние и внешние. [5]
Скорость и характер процесса электрохимической коррозии металлов зависят от многих факторов, которые подразделяются на внутренние и внешние. [6]
Принципиальная возможность или невозможность самопроизвольного протекания процесса электрохимической коррозии металла, так же как и химической коррозии, определяется знаком изменения свободной энергии процесса. При электрохимической коррозии металлов для расчетов более удобно пользоваться электрохимическими данными - электродными потенциалами. [7]
Коррозионные диаграммы имеют большое значение для изучения и расчетов процессов электрохимической коррозии металлов. На основании коррозионной диаграммы можно определить величину тока пары и, следовательно, скорость коррозии анода ( саморастворение - растворение вследствие работы микропар при этом не учитывается, так как оно мало по сравнению с контактной коррозией), установить контроль коррозионного процесса и дать его количественную оценку. [8]
Закономерности, наблюдаемые при работе гальванических элементов, позволяют понять процесс электрохимической коррозии металлов. Механизм электрохимической коррозии связан с образованием гальванической пары при контакте двух металлов различной активности, контакте металла и сплава, образованием микрогальванических пар из зерен разных металлов в эвтектиче1 ских сплавах и. Металлы высокой степени чистоты - более коррозионно устойчивы. [9]
Медные накипи резко отрицательно сказываются на работе поверхностей нагрева: интенсифицируется процесс электрохимической коррозии металла под отложениями, увеличивается термическое сопротивление трубы за счет слоя малотеплопроводных отложений, что в дальнейшем вызывает снижение нагрузки парогенератора или параметров пара. [10]
Согласно более ранней, имеющей почти полуторавековую историю, гетерогенной трактовке процессов электрохимической коррозии металлов ( теории локальных элементов), участки анодной и катодной реакций пространственно разделены и для протекания коррозии необходим переток электронов в металле и ионов в электролите. [11]
Взаимодействие стальных труб с водопроводной водой, представляющей слабый электролит, является процессом электрохимической коррозии металла и сопровождается протеканием электриче ского тока от одних участков поверхности металла к другим. [12]
Однако эти рекомендации являются вынужденными и вовсе не исключают необходимости проведения дальнейших исследований моделирующих установок для изучения процессов электрохимической коррозии металлов. [13]
Коррозия металлов блуждающими токами является частным, но наиболее распространенным и имеющим большое практическое значение случаем влияния электрического поля в электролите на процесс электрохимической коррозии металлов. [14]
Электрохимия изучает свойства растворов электролитов, связанные с наличием в них ионов, явления электролиза, действие химических источников тока, сущность процессов электрохимической коррозии металлов. [15]
Страницы: 1 2