Процесс - химическое меднение
Cтраница 1
Процесс химического меднения проводят из раствора, содержащего 30 г / л ( Ссм) CuSO4 - 5 H2O ( СМ), 40 г / л ( Сщ) NaOH ( щ) и 25 мл / л ( Сф) 40 % - ного ( р) ( с содержанием 40 г СН2О в 100 мл) раствора формалина СНаО ( Ф) и некоторые другие компоненты. [1]
Процесс химического меднения проводится из раствора, содержащего 30 г / л ( Сем) CuSO4 - 5H2O ( CM), 40 г / л ( Сщ) NaOH ( щ) и 25 мл / л ( СФ) 40 % - ного ( р) ( с содержанием 40 г СН2О в 100 мл) раствора формалина СН2О ( Ф) и некоторые другие компоненты. [2]
Процессу химического меднения предшествуют операции сенсибилизации и активации поверхности, которые проводятся для придания диэлектрику способности к металлизации. Эти операции выполняют, обрабатывая поверхности в растворах двухлористого олова и хлористого палладия. [3]
 |
Шлифованная плата печатной схемы из фотокерама. [4] |
Сущность процессов химического меднения и никелирования состоит в восстановлении металлов из их солей различными восстановителями. При подкислении раствора этого комплекса образуется Си 2 и выделяется металлическая медь. [5]
Для ускорения процесса химического меднения предложено наложить переменное электромагнитное поле - пропускать через раствор переменный ток частотой порядка 50 Гц [57] - при этом меднение может ускориться в несколько раз. Такой процесс является сочетанием химического и гальванического методов осаждения покрытий. [6]
Для осуществления процесса химического меднения рекомендуется много разнообразных растворов. Состоят они из соли двухвалентной меди ( чаще всего сернокислой), комплексообразователя, восстановителя - формалина, стабилизирующих и ускоряющих добавок, гидроокиси натрия, регулирующей кислотность раствора. В зависимости от комплексообразователя различают виннокислые, трилоно-вые ( этилендиаминтетрауксуснокислые), лимоннокислые, глицериновые и другие растворы. [7]
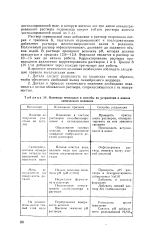 |
Основные неполадки и способы их устранения в ваннах химического меднения. [8] |
Детали в процессе химического меднения необходимо покачивать с целью обновления раствора, соприкасающегося с их поверхностью. [9]
В настоящее время процесс химического меднения часто рассматривают как сопряженный электрохимический процесс ( см. гл. Однако в присутствии ЭДТА [19, 107], ТЭА [19], в концентрированном тартратном растворе как без добавок, так и в присутствии стабилизаторов [109], а также в тартратном растворе с добавкой гуминовых кислот [ ПО ] скорость модельного процесса значительно ниже, чем скорость реального каталитического процесса. Такие различия могут быть результатом как взаимодействия отдельных электрохимических процессов, например, их ускорения при совместном протекании, так и участия в процессе восстановления чисто химического механизма. [10]
Следующий за этим процесс химического меднения основан на восстановлении металлической меди из водного раствора солей при воздействии восстановителей. После меднения защитную краску, которой были покрыты все места основания, свободные от электропроводящих элементов схемы, снимают органическим растворителем. [11]
Далее основания подвергаются процессу химического меднения, который основан на способности металлической меди восстанавливаться из водного раствора своих солей при действии на них восстановителей. Медь в водном растворе находится в виде комплексного соединения - куприта меди Си ( ОН) 2 -) - 2NaOH Na2 [ Cu ( OH) 4 ], из которого она легко восстанавливается при действии органического восстановителя. В качестве восстановителя применяется сорокапроцентный водный раствор формалина. [12]
Этот раствор не ухудшает процесс химического меднения. [13]
При рН 11 восстанавливающая способность формальдегида слишком мала для начала процесса химического меднения. Видимо, поэтому указывается [20], что из карбонатного раствора медь формальдегидом не восстанавливается. То же самое обнаружено и для аммиачных комплексов [20], что может объясняться двумя причинами: во-первых, как установлено нами, аммиак тормозит восстановление меди в тартратных растворах, во-вторых, аммиак реагирует с СН2О, образуя соединения с более слабыми восстановительными свойствами. [14]
При рН И восстанавливающая способность формальдегида слишком мала для начала процесса химического меднения. Видимо, поэтому в литературе указывалось, что из карбонатного раствора медь формальдегидом не восстанавливается. То же самое обнаружено и для аммиачных комплексов, что может объясняться двумя причинами: во-первых, как установлено нами, аммиак тормозит восстановление меди в тартратных растворах, во-вторых, аммиак реагирует с СН2О, образуя соединения с более слабыми восстановительными свойствами. [15]
Страницы: 1 2