Процесс - образование - ионные пары
Cтраница 1
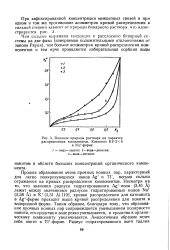 |
Влияние природы раствора на характер. [1] |
Процесс образования очень прочных ионных пар, характерный для легко поляризующихся ионов Ag и Т1, весьма сильно отражается на кривых распределения компонентов. Несмотря на то, что значения радиуса гидратированного Ag - Hona ( 3 41 А) лежат между значениями радиусов гидратированных ионов Na ( 3 58 А) и К ( 3 31 А) [10], кривая распределения для катионита в А § - форме проходит выше кривой распределения для ионита в водородной форме. Таким образом, благодаря тому, что образование прочных ионных пар сопровождается уменьшением полярности ионита, его сродство к воде резко уменьшается, а сродство к органическому компоненту увеличивается. Аналогичным образом ведет себя ионит в Т1 - форме. [2]
Известны как процессы образования ионных пар, сопровождающиеся полной или частичной дегидратацией ионов, так и процессы, не сопровождающиеся изменением гидратных оболочек ионов. Ионные пары имеют очень высокие дипольные моменты. [3]
При изучении процессов образования ионных пар могут встретиться и другие химические реакции. В растворителях класса простых эфиров в равновесии с мономерными частицами находятся парамагнитные димеры кетилов ( см. разд. [4]
В расчете не принимается во внимание процесс образования ионных пар, что также приводит к некоторому искажению результата, но уже за счет не кинетических, а термодинамических факторов. [5]
С учетом диффузии в пограничном слое и процесса образования ионных пар удается получить существенную информацию о кинетике быстрой диссоциации молекул НА. [6]
Следует еще раз подчеркнуть, что такого рода реакции могут играть важную роль в исследованиях процессов образования ионных пар анион-радикалами и существенно изменять конечные выводы из таких экспериментов. В частности, реакции диспро-порционирования могут создавать помехи при исследовании зависимости поведения ионных пар и равновесия димеризации от катиона, растворителя и температуры и в конечном счете натолкнуть на ошибочную интерпретацию спектров ЭПР. [7]
Перемена направлений магнитных потоков и связанное с ней изменение направлений движения ионов в свою очередь существенно облегчает процесс образования ионных пар и более сложных агрегатов, так как при этом вероятность сближения разноименно заряженных частиц возрастает. [8]
Изменение энтальпии АЯ -, определяющее равновесие между двумя видами ионных пар, - важная термодинамическая характеристика энергетики процесса образования ионных пар. [9]
 |
Протокол прогонки программы ПРЕДОЧ. [10] |
Можно перечислить основные направления этой работы: учет кинетических факторов процесса выпадения твердой фазы карбоната кальция и гидроксида магния, учет процесса образования ионных пар [8], определение произведений растворимости карбоната кальция и гидроксида магния по температуре раствора, как это делается в программе ПРЕДОЧ для ионного произведения воды и констант диссоциации угольной кислоты. [11]
Следовательно, раствор атомов щелочного металла должен находиться в равновесии с соответствующими ионными парами, причем предполагается, что константа равновесия для процесса образования ионных пар будет возрастать с усилением сольватирующей способности растворителя. [12]
В растворителях с высокой диэлектрической проницаемостью, таких, как вода ( е 78 5 при 25 С), сила притяжения между компонентами ионной пары относительно мала и диссоциация проходит практически нацело. В растворителях с низкой диэлектрической проницаемостью в значительной степени идет процесс образования ионных пар; одновременно с этим образуются более сложные ионные агрегаты. [13]
При сравнении данных для различных растворителей практически могут быть приняты во внимание и объяснены только термодинамические эффекты, а специфическое влияние растворителей, зависящее от строения молекулы растворителя, можно учесть лишь эмпирически. Кроме того, в зависимости от природы растворителя меняется диэлектрическая проницаемость, а это влияет на процесс образования ионных пар. [14]
Воздействуя на молекулы воды, составляющие ближнее и дальнее окружение ионов, ослабляя связи одних и усиливая связи других, магнитное поле вызывает асимметрию гид-ратных оболочек; в результате этого создаются условия для образования ионных ассоциатов - зародышей кристаллов. Перемена направлений магнитных потоков и связанное с этим изменение направлений движения ионов в свою очередь существенно облегчает процесс образования ионных пар и более сложных агрегатов, так как вероятность сближения разноименно заряженных частиц возрастает. [15]
Страницы: 1 2