Процесс - электролитическое окисление
Cтраница 2
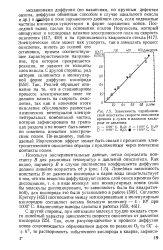 |
Зависимость параболической константы скорости окисления кремния в сухом и влажном кислороде от давления. [16] |
Электрическое поле может как ускорять, так и замедлять процесс окисления, вплоть до полной его остановки, причем соответствующее характеристическое напряжение, при котором прекращается реакция, не зависит от толщины слоя окисла. Так, Реллей обращает внимание на то, что в стационарном процессе электрическое поле не должно влиять на скорость окисления, так как в конечном итоге окисление обусловлено разностью химических потенциалов электронейтральных комбинаций частиц, которая зафиксирована на границах раздела и не может быть заметно изменена внешним электрическим полем. По-видимому, наблюдаемый Иоргенсеном эффект может быть связан с процессами электролитического окисления образца с приложенным через омические контакты полем. [17]
В этом случае говорят, что окись свинца при нагревании с углем восстанавливается до свинца. Но в электрохимическом смысле и переход хлорида свинца в свинец также является восстановительным процессом; в общем случае всякий процесс, при котором положительный заряд какого-нибудь вещества понижается или его отрицательный заряд повышается, является процессом восстановления. Восста-ноиительные процессы могут совершаться также и электролитическим путем, причем они происходят на катоде, в то время как процессы электролитического окисления протекают на аноде. [18]
В этом случае говорят, что окись свинца при нагревании с углем восстанавливается до свинца. Но в электрохимическом смысле и переход хлорида свинца в свинец также является восстановительным процессом; в общем случае всякий процесс, при котором положительный заряд какого-нибудь вещества понижается или его отрицательный заряд повышается, является процессом восстановления. Восстановительные процессы могут совершаться также и электролитическим путем, причем они происходят на катоде, в то время как процессы электролитического окисления протекают на аноде. [19]
Функциональная нитро-группа легко восстанавливается и в про-тонодонорных, и в апротонных растворителях. Эта реакция в водных растворах вызывает интерес с точки зрения аналитической; в апротонных системах она привлекла значительное внимание как удобный путь к получению стабильных анион-радикалов ароматических нитросоединений. Восстановлением алифатических нитро-соединений, которые образуют значительно менее устойчивые радикалы, занимались относительно мало. Нитро-группа чрезвычайно устойчива к анодному окислению, так что нитрометан является удобным растворителем для процессов электролитического окисления. В литературе, по-видимому, имеются данные о систематических исследованиях анодного окисления только ароматических нитросоединений; при этом происходит удаление электрона с наивысшей заполненной орбитали, на которое нитро-группа заметно не влияет. [20]
Страницы: 1 2