Процесс - окисления-восстановление
Cтраница 1
Процессы окисления-восстановления играют исключительно большую роль в органической и неорганической природе. [1]
Процессы окисления-восстановления всегда связаны с переходом ( отдачей или присоединением) электронов и сопровождаются соответственно увеличением или уменьшением валентности элемента. [2]
Процесс окисления-восстановления, который происходит под действием постоянного электрического тока, называется электролизом. [3]
Процесс окисления-восстановления - это процесс, сопровождающийся передачей электронов от восстановленной формы к окисленной. [4]
Какие процессы окисления-восстановления протекают на катоде и на аноде при электролизе водного раствора NiCl2: а) если анод никелевый, б) если анод угольный. [5]
Какие процессы окисления-восстановления протекают на катоде и аноде при электролизе водного раствора CdCl: а) при кадмиевом аноде; б) при угольном аноде. [6]
Каждый процесс окисления-восстановления характеризуется своей кривой титрования, изображающей изменение окислительно-восстановительного потенциала в процессе титрования. [7]
Примером процессов окисления-восстановления могут служить реакции вытеснения металлов из растворов их солей другими металлами, например CuSO4 ZnCu - f ZnSCk. Атом цинка теряет 2 электрона и становится двухзарядным положительно, в то время как ион меди, имевший 2 положительных заряда, приобретает 2 электрона и становится нейтральным атомом. [8]
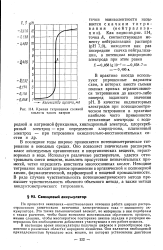 |
Кривая титрования соляной. кислоты едким натром. [9] |
На процессах окисления-восстановления основана работа широко распространенного химического источника электрического тока - свинцового аккумулятора. Это также гальванический элемент, но материалы в нем подобраны с таким расчетом, чтобы была возможна максимальная обратимость процесса, иными словами, чтобы многократное повторение циклов зарядки и разрядки совершалось без необходимости добавления участвующих в его работе веществ. [10]
В процессе окисления-восстановления окислители принимают, а восстановители отдают электроны. Окислителями и восстановителями могут быть молекулы, атомы, ионы. [11]
На процессах окисления-восстановления в аналитической химии основаны методы объемного анализа: перманга-натометрия, иодометрия, броматометрия и другие, играющие важную роль при контролировании производственных процессов и выполнении научных исследований. Поэтому окислительно-восстановительным реакциям, как разделу курса Общей химии, необходимо уделить должное внимание. [12]
Очевидно, процесс окисления-восстановления, в сущности, состоит в переходе электронов от атома или иона окисляемого элемента к атому или иону восстанавливаемого. Таким образом, окисление-восстановление является единым электронным процессом. [13]
Нагревание способствует процессу окисления-восстановления. [14]
Отнесение к процессам окисления-восстановления реакций, в которых кислород и другие электроотрицательные элементы выступают в роли акцепторов электронов, а водород и другие электроположительные элементы - в роли доноров электронов, недостаточно. [15]
Страницы: 1 2 3 4