Процесс - ионообменная сорбция
Cтраница 1
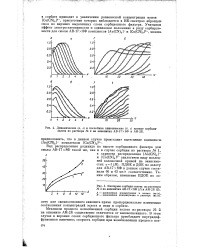
Процесс ионообменной сорбции обычно осуществляют путем фильтрации раствора через слой ионита. Низкая прочность ионита может привести к быстрому истиранию зерен под давлением слоя сорбента и жидкости, что увеличивает сопротивление фильтра движению жидкости. [1]
Механизм процесса ионообменной сорбции золота из раствора № 2: на анионите АМ-2Б существенно отличается от вышеописанного. [3]
В процессах ионообменной сорбции в простейшем случае участвуют два компонента - ион адсорбируемый и ион вытесняемый. [4]
Законы, управляющие процессами ионообменной сорбции, происходящими в природе или осуществляемыми в технике, до сего времени изучены недостаточно. Еще не установлены основные факторы, определяющие процесс ионообмена на различных сорбентах и в различных условиях. Окончательно не раскрыты природа явлений, происходящих при ионообмене между твердой и жидкой фазами, и причины возникновения вторичных процессов. Не проверены также известные уравнения изотермы обмена ионов и не выбрано наиболее рациональное уравнение изотермы, которое удовлетворительно описывало бы количественную сторону процесса и служило бы основанием для расчета. [5]
Это явление взаимного вытеснения компонентов в процессе ионообменной сорбции в динамических условиях может иметь большое практическое значение. В описанных выше опытах максимальное насыщение колонки стрептомицином превышает в несколько раз равновесное насыщение, наступавшее в тот момент, когда концентрация стрептомицина в фильтрате снова падает до его концентрации в исходном растворе. [7]
В настоящей работе предлагается новый подход к интенсификации процесса ионообменной сорбции, основанный на использовании зерен ионитов малого размера. В связи с этим возникла необходимость изучения законов кинетики ионного обмена и определения стадии [12 13], определяющей скорость процесса при использовании сильноизмельченных зерен ионитов. [8]
Ферритизация сильноосновного анионита не оказывает заметного влияния на характер процесса ионообменной сорбции. [9]
Рассматривая проблемы крупномасштабного препаративного выделения физиологически активных веществ, в частности на основе процессов ионообменной сорбции, следует подчеркнуть, что создание и использование высокоспецифических сорбентов, современной теории равновесия, кинетики и динамики ионного обмена открывает принципиально новые возможности для разделения, выделения и очистки ФАВ. [10]
Следует заметить, что выбор иони-тов может быть и другим без принципиальных изменений в ходе процесса ионообменной сорбции. [11]
 |
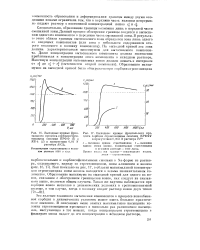
Зависимость от рН раствора эквивалентности ионного обмена с участием окситетрациклина на сульфока-тионите СБС-3. [12] |
В соответствии с этим можно было бы полагать, что при рН pKul происходит протонирование окситетрациклина в процессе ионообменной сорбции, что соответствует уменьшению его сорбируемости катионитами в статическом эксперименте ( рис. 3.38) при увеличении рН раствора. Снижение сорбируемости в кислотной области соответствует конкуренции с ионами натрия. Однако обмен ионов окситетрациклина с ионами натрия происходит эквивалентно в более значительном интервале рН ( рис. 3.39), что указывает на возможность существования второй формы резината, включающего окситетрациклин, вероятно в виде сорбированного диполярного иона. В связи с этим ионный обмен с участием ионов группы тетрациклина был изучен при рН pKai, ионный обмен с участием ионов водорода проводился при рН С 2, а ионный обмен с участием ионов натрия - при рН 1.9. В последнем случае концентрация ионов натрия должна существенно превосходить концентрацию ионов водорода, для того чтобы поправка на тройную систему ТЦ - Na - H была бы незначительной. [13]
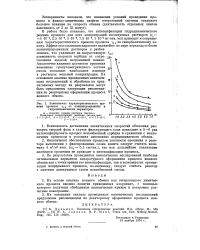 |
Зависимость характеристического вре - 5 ыени процесса т0 - 9 от концентрационных и гидродинамических параметров. [14] |
Возможность достижения значительных скоростей обтекания раствором твердой фазы в случае фильтрующего слоя позволяет в 5 - 6 раз интенсифицировать процесс ионообменной сорбции в сравнении с аналогичным процессом в условиях интенсивно перемешиваемого объема. [15]
Страницы: 1 2