Процесс - восстановление - ион - водород
Cтраница 2
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительное, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду стандартных окислительно-восстановительных потенциалов вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда - приблизительно до титана. [16]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-иее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, С г, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [17]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олоза) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [18]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [19]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам откосятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условии электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [20]
Коррозия металлов в кислотах с неокисляющим анионом ( например, НС1, разбавленная H2SO4) протекает преимущественно с водородной деполяризацией. Основным катодным процессом при этом является процесс восстановления ионов водорода. [21]
Здесь нужно учитывать величину потенциал 1, процесса восстановления ионов водорода. [22]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации4, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно. [23]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необход и м а определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно. [24]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно. [25]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. [26]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное вос - - становление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется чеще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно. [27]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление ионов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапряжением данного электродного процесса. Таким образом, перенапряжение выделения водорода на различных металлах различно. [28]
Кроме величины поляризации на скорость электродных процессов влияют некоторые другие факторы. Рассмотрим катодное восстановление попов водорода. Если катод изготовлен из платины, то для выделения водорода с заданной скоростью необходима определенная величина катодной поляризации. При замене платинового электрода на серебряный ( при неизменных прочих условиях) для получения водорода с прежней скоростью понадобится большая поляризация. При замене катода на свинцовый поляризация потребуется еще большая. Следовательно, различные металлы обладают различной каталитической активностью по отношению к процессу восстановления ионов водорода. Величина поляризации, необходимая для протекания данного электродного процесса с определенной скоростью, называется перенапря-х е и п е м данного электродного процесса. Таким образом, пере-напряженке выделения водорода на различных металлах различно. [29]
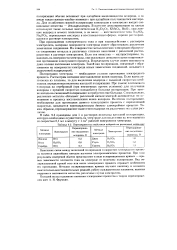 |
Перенапряжение выделения водорода на различных металлах. [30] |
Страницы: 1 2 3