Процесс - восстановление - ион - водород
Cтраница 1
Процесс восстановления ионов водорода был предметом весьма многочисленных исследований - в этом отношении с ним не может конкурировать ни одна электродная реакция. [1]
Процесс восстановления ионов водорода, выражаемый суммарной реакцией (1.2), - одна из наиболее интенсивно изучаемых электрохимических реакций. Она служит той моделью, на примере которой установлены общие законы электрохимической кинетики. [2]
Сопротивление процессу восстановления иона водорода ( присоединения электрона и образования молекулы На) является причиной возникновения активационной поляризации. Такая поляризация была названа водородным перенапряжением или перенапряжением выделения водорода. Чем больше перенапря - жение выделения водорода, тем медленнее протекает сопряженный анодный процесс - коррозия металла. Полировка поверхности металла, понижение температуры электролита и увеличение плотности поляризующего тока - все эти факторы влияют на увеличение перенапряжения выделения водорода. [3]
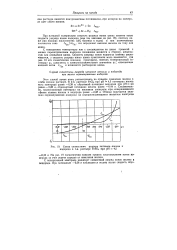 |
Схема совместного разряда катионов железа и 1водорода в 1-я. растворе РеЗСч при рН 4 5. [4] |
На рис. 19 схематически показан процесс восстановления ионов водорода за счет отдачи зарядов от окисления железа. [5]
В качестве примера рассмотрим более подробно кинетику процесса восстановления иона водорода ( гл. [6]
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительное, чем - 0 41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Сг, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [7]
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно прежде всего учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит, как указывалось выше, от концентрации ионов водорода ( см. стр. Отсюда ясно, что если электролит образован металлом, электродный потенциал которого значительно положительнее, чем - 0 41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду стандартных потенциалов вблизи водорода ( начиная приблизительно от олова) и после него. В случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем - 0 41 В, на катоде будет выделяться водород. К таким металлам относятся металлы начала ряда стандартных потенциалов - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то, в зависимости от концентрации раствора, температуры и плотности тока, возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [8]
Схемы ( IX, 64) и ( IX, 65) не исчерпывают возможных путей протекания процесса восстановления ионов водорода. [9]
В сосуде I идет процесс окисления тита-на ( Ш) до титана ( IV), а в сосуде 7 - процесс восстановления ионов водорода до свободного молекулярного водорода. В этом случае напряжение гальванического элемента принято брать с противоположным знаком: - 0 1 В. [10]
Молекулярный водород удаляется в виде пузырьков. Сопротивление процессу восстановления иона водорода ( присоединения электрона и образования молекулы Н2) является причиной возникновения активационной поляризации. Такая поляризация была названа водородным перенапряжением или перенапряжением выделения водорода. Чем больше перенапряжение выделения водорода, тем медленнее протекает сопряженный анодный процесс - коррозия металла. [11]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно - до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [12]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [13]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем - 0 41 В, то из нейтрального раствора такого электролита ка катоде будет выделяться металл. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [14]
Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода ( см. стр. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положитель-нее, чем - 0 41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода ( начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем - 0 41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине - 0 41 В ( металлы средней части ряда - Zn, Cr, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода. [15]
Страницы: 1 2 3