Процесс - электрохимическое восстановление
Cтраница 3
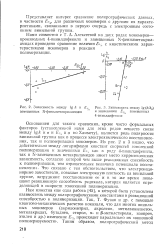 |
Зависимость между lg k и., замещенных N-фенилметакриламидов.| Зависимость между lg ( k / k и значениями. замещенных. [31] |
Хаммету), является роль полярности винильной группы как в процессе электрохимического восстановления, так и полимеризации мономеров. Из рис. 2 и 3 видно, что действительно между логарифмами констант скоростей гомогенной полимеризации и значениями Еч, как в ряду 4-винилдифенила, так и N-замещенных метакриламидов имеет место корреляционная зависимость, согласно которой чем выше реакционная способность к полимеризации, тем отрицательнее величина потенциала восстановления. Это связано с тем обстоятельством, что электронодо-норные заместители, повышая электронную плотность ка винильной группе, затрудняют восстановление ее и в то же время повышают реакционную способность радикала, которая является определяющей в скорости гомогенной полимеризации. [32]
Процессы электрохимического окисления органических веществ изучены в гораздо меньшей степени, чем процессы электрохимического восстановления. Это связано с тем, что процессы анодного окисления часто сопровождаются ионизацией материала анода и образованием на поверхности электрода пленок окислов. [33]
 |
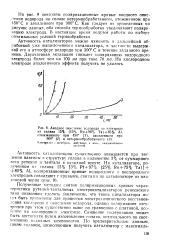
Поляризационные кривые в 5 и. растворе NaCl при 80 С на анодах. ОРТА ( 7. графит ( 2. МпО2 ( 3. РЬО2 ( 4. платинотитановом ( 5 и магнети-товом ( 6. [34] |
Низкая адсорбируемость органических соединений на магнетите - позволила применять его в качестве анода в процессах электрохимического восстановления, когда необходимо предотвратить окисление исходного и конечного продуктов. Использование магнетитового анода позволяет вести процесс в электролизере без диафрагмы, что значительно облегчает и интенсифицирует восстановительный процесс. [35]
Совершенно недостаточное внимание уделяется у нас вопросам электрохимического синтеза неорганических и органических веществ и изучению кинетики процессов электрохимического восстановления органических соединений при помощи полярографического метода, включая осциллографическую полярографию. [36]
Природа электрода, так же как и степень развития его поверхности, играют важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо она проявляется в случае сложных окислительно-восстановительных реакций. Найдено, что, например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. При плотности тока 0 24 а / см2 на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. [37]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [38]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления: особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Найдено, например, что при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксила-мин. При плотности тока, равной 0 24 а / см2, на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. [39]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Найдено, например, что при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. При плотности тока, равной 0 24 а / см2, на медном катоде 98 5 % тока расходуется на образование аммиака и только 1 5 % - на образование гидроксиламина. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [40]
Природа электрода, так же как и степень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления; особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце - преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. [41]
 |
Анодное окисление водорода на электроде. [42] |
Полученные методом снятия поляризационных кривых характеристики рутений-танталовых электрокатализаторов ренеевского типа позволяют сделать заключение, что такие катализаторы могут быть применены для процессов электрохимического восстановления кислорода и окисления водорода, однако поляризация электродов при этом существенно выше по сравнению с платиной, особенно на кислородном электроде. Снижение поляризации может быть достигнуто путем изготовления сплава, оптимального по соотношению исходных компонентов. [43]
Отмеченный эффект сопряжения связан, по-видимому, с тем обстоятельством, что, кроме понижения уровня низшей разрыхляющей орбитали, в процессе электрохимического восстановления органических молекул на ртутном электроде определенную роль играет поляризующее действие на них поля электрода. Он состоит в том, что под влиянием поля электрода в молекуле происходит, особенно при наличии системы сопряженных связей, перераспределение электронной плотности, благодаря чему появляются места ( атомы или группы атомов) с наведенным положительным зарядом ( или вообще с пониженной электронной плотностью), способные легче воспринимать электроны от электрода. [44]
 |
Полярографические характеристики хинобромистых соединений. [45] |
Страницы: 1 2 3 4