Процесс - электролитическое выделение
Cтраница 1
 |
Установка для внутреннего. [1] |
Процесс электролитического выделения при этом несколько удлиняется - до 50 минут, но зато при этом можно выделить до 120 мг металла. [2]
Процессы электролитического выделения металлов на ртутных катодах, а также цементация при помощи амальгам имеют преимущества перед электроосаждением на твердых катодах: а) может быть устранено совместное выделение водорода ввиду большого перенапря жения его на ртути, б) устраняется образование дендритов и т.п., в) при цементации амальгамами разных металлов возможно фракционированное разделение металлов; например, если обработать раствор, содержащий медь, свинец и цинк амальгамой цинка, то сначала будет переведена в амальгаму более электроположительная медь, а затем уже только свинец. Такие процессы, также как и анодное растворение амальгам, легко подвергнуть контролю и автоматизации путем измерения электродного потенциала амальгамы. Метод термической отгонки ртути из амальгам позволяет получать щелочные металлы. Метод фильтрации позволяет выделять из амальгам порошкообразные: марганец, хром, железо, никель, кобальт для металлокерамики ( см. гл. [3]
Изучением процессов электролитического выделения рения и его сплавов [4] особенно усиленно занимаются в последнее время. Рений и его сплавы обладают рядом ценных свойств, благодаря которым они находят широкое применение в различных областях промышленности, особенно в таких, как электронная и радиотехническая. Электрохимический метод по сравнению с другими методами имеет то преимущество, что наряду с простотой и дешевизной позволяет получать чистый металл, практически не содержащий примесей. [4]
В процессах электролитического выделения кислорода из водных растворов происходит переход электрона от гидроксильных ионов или от молекул воды к электроду. [5]
Естественно, что для ускорения процесса электролитического выделения металла следует, по возможности, подбирать электролиты с максимальной величиной электрохимического эквивалента осаждаемого металла. Применяя электролит с большей величиной электрохимического эквивалента, для некоторых покрытий при одинаковом режиме электролиза удается получать значительно большее количество осаждаемого металла. Так, например, применение медных цианистых быстродействующих электролитов вместо кислых дает возможность при одинаковых условиях осаждать в два раза больше меди, так как величина электрохимического эквивалента меди в медных цианистых электролитах в два раза больше, чем в кислых. По этой же причине, применяя покрытия оловом в кислых электролитах вместо станнатных, получаем двойное увеличение выделившегося осадка олова. При золочении в цианистых электролитах выделяется в три раза больше металла, чем в железосинеродистых электролитах, в которых золото находится главным образом в виде трехвалентных соединений. [6]
В зависимости от состава раствора, подвергающегося электролизу, процесс электролитического выделения кислорода может протекать различными путями. При электролизе растворов щелочей наиболее вероятным источником анодного кислорода являются ионы гидроксила. [7]
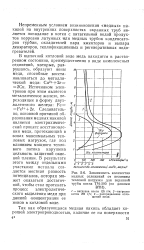 |
Зависимость количества медных отложений от величины. [8] |
РУбы котла: 2 - 00 ( по данным процесс электролитического выделения меди при данной ( концентрации ее ионов в котловой воде. [9]
В зависимости от состава раствора, подвергающегося электролизу, процесс электролитического выделения кислорода может протекать различными путями. При электролизе растворов щелочей наиболее вероятным источником анодного кислорода являются ионы гидроксила. [10]
Из табл. 3 и рис. 3 видно, что процесс электролитического выделения урана заканчивается через 2 часа, плутония - через 60 мин. [11]
До сих пор нами рассматривался идеальный случай, когда процесс электролитического выделения металла протекает только с концентрационной поляризацией. Однако наблюдаемая при возникновении и росте кристаллов поляризация не может быть сведена только к концентрационной. Она обусловливается также разрядом и дегидратацией ионов и, кроме того, процессом осаждения атомов металла в кристаллическую решетку. [12]
В зависимости от состава раствора, подвергающегося электролизу, процесс электролитического выделения кислорода может протекать различными путями. При электролизе растворов щелочей наиболее вероятным источником анодного кислорода являются ионы гидроксила. [13]
Уравнение ( 8) правильно передает зависимость энергии активации процессов электролитического выделения водорода от атомного радиуса металла. На рис. 3 приведены зависимости энергии активации от г. Кривая построена с использованием опытного значения энергии активации для ртути. [14]
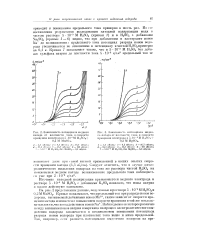 |
Зависимость потенциала мндиого. [15] |
Страницы: 1 2 3