Процесс - электролитическое выделение
Cтраница 2
Наблюдаемое некоторое различие между влиянием ионов натрия и марганца па процесс электролитического выделения водорода заключается в неодинаковом повышении потенциала разряда ионов водорода при плотностях тока выше и ниже предельной. [16]
Полученные опытные данные, не укладывающиеся в рамки ни одной из существующих теорий, указывают па сложность механизма процесса электролитического выделения хлора, меняющегося с изменением условий электролиза. [17]
Простейший, с этой точки зрения, случай - выделение жидкого металла из водного раствора на инородной твердой поверхности - аналогичен рассмотренному в главе I процессу электролитического выделения газов. Для вычисления работы и вероятности образования зародышей капель были даны уравнения ( 2) и ( 6) ( см. стр. [18]
Таким образом анализ опытных величин перенапряжений водорода показывает, что их зависимость от природы металла согласуется с ожидаемой на основе применения мультиплетной теории катализа к процессу электролитического выделения водорода. [19]
 |
Установка для внутреннего. [20] |
При проведении электролиза с защитной пленкой тщательно очищенный анод погружают 2 - 3 раза в раствор коллодия и дают коллодиевой пленке высохнуть. Процесс электролитического выделения при этом неколько удлиняется, но зато можно выделить большее количество ( до 120 мг) металла. [21]
Электроды для электрохимического выделения золота изготавливают из стеклоуглерода. Процесс электролитического выделения золота ведут при напряжении 4 - 5 В, плотности тока 20 - 30 А / дм2 в течение 2 - 3 ч, расход электроэнергии - 0 2 - 0 4 кВт - ч на 1 г золота. [22]
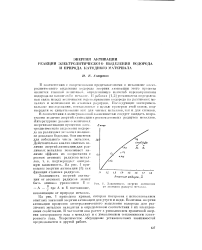 |
Зависимость. шергии активации от атомного радиуса металла. [23] |
На рис. 1 приведена кривая, которая построена с использованием опытных значений энергии активации для ртути и меди. Величина энергии активации процессов электролитического выделения водорода для различных металлов находится в определенном соответствии с их электронными свойствами. В частности она растет с уменьшением граничной энергии электронного газа в металлах и с уменьшением теплоемкости электронного газа. Теоретическое обсуждение установленных зависимостей предполагается в другой работе. [24]
Установлено, что при облучении электролизера ультразвуком значительно снижается процесс газонаполнения электролита, в результате чего падает омичеокое сопротивление электролита при электролизе, что может эффективно сказаться на снижении расхода электроэнергии на единицу продукта. При изучении влияния ультразвука на процесс электролитического выделения дейтерия также было установлено быстрое удаление газов с полированного платинового электрода. Предполагают, что это предотвращает осуществление реакции поверхностно-каталитического типа между разряжающимся водородом и электролитом. В результате этого повышается коэффициент выделения дейтерия. [25]
В соответствии с вышеуказанной зависимостью следует ожидать возрастания величин энергий активации с ростом атомных радиусов металлов. Литературные данные о величинах энергии активации процессов электролитического выделения водорода на различных металлах являются довольно бедными. Они имеются для небольшого числа металлов. На рис. 1 приведены энергии активации [3] как функции атомных радиусов. [26]
Последний вопрос заслуживает особого внимания, так как он дает возможность значительно увеличить производительность гальванических цехов во многих случаях без больших материальных затрат, главным образом за счет внедрения быстродействующих электролитов. К тому же нередко, помимо интенсификации процесса электролитического выделения металла из такого электролита, удается получить блестящие металлические осадки, в результате чего может быть полностью или частично заменена доследующая механическая обработка гальванического покрытия. Поэтому интенсификация гальванических процессов за счет применения быстродействующих электролитов должна находить все более широкое применение. [27]
Следовательно, основной причиной образования накипей является электрохимический процесс восстановления меди, протекающий в зонах максимальных тепловых нагрузок, где под влиянием мощного теплового потока нарушена цельность защитной окисной пленки. В результате этого между отдельными участками металла создается местная разность потенциалов, которая может оказаться достаточной, чтобы стал протекать процесс электролитического выделения меди при данной концентрации ее ионов в котловой воде. Так как образующаяся медная накипь обладает хорошей электропроводностью, наличие ее на поверхности нагрева не является существенной помехой для продолжения электрохимических процессов, в результате которых выделяются новые порции металлической меди. [28]
Следует отметить, что несмотря на тщательное обезвоживание препаратов и применение защитной атмосферы аргона как при электролизе, так и при извлечении катодного осадка, полученные металлические порошки циркония содержат не более 98 % активного металла и являются хрупкими независимо от их структуры. Такой металл не удовлетворяет требованиям, предъявляемым к металлическому цирконию. В связи с этим был изучен процесс электролитического выделения циркония из хлоридных расплавов с растворимым анодом с целью выяснения возможности электрорафинирования циркония из этих расплавов. [29]
Нанесение цинковых гальванических покрытий, являющееся хорошо известным промышленным процессом, сопряжено с рядом трудностей. Одной из них является необходимость удаления сульфата магния, накапливающегося в электролите в результате циркуляции сернокислого раствора, подаваемого из электролизера на стадию экстракции сульфата цинка из цинковой руды и вновь возвращаемого на электролиз. Присутствие солей магния в концентрациях выше допустимой оказывает отрицательное влияние на процесс электролитического выделения цинка, приводя к ухудшению качества получаемого продукта и снижая его выход. [30]
Страницы: 1 2 3