Процесс - гидролиз - соль
Cтраница 1
 |
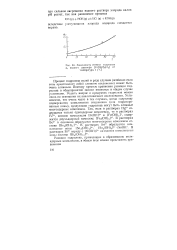
Зависимость степени гидролиза Na СО, от разбавления при 20 С [ IMAGE ] Зависимость степени гидролиза J Cr / Н О I С1 от температуры. [1] |
Процесс гидролиза солей в ряде случаев может быть очень сложным. Поэтому простые уравнения реакции гидролиза в общепринятой записи часто являются условными. [2]
 |
Зависимость степени гидролиза. [3] |
Процесс гидролиза солей в ряде случаев ( особенно если соль представляет собой сложное соединение) может быть очень сложным. Поэтому простые уравнения реакции гидролиза в общепринятой записи являются в общем случае условными. [4]
Процесс гидролиза солей является реакцией, обратной процессу нейтрализации. [5]
 |
Зависимость степени гидролиза Na СО. от разбавления при 20 С.| Зависимость степени гидролиза I Cr / H O g IC1 От температуры. [6] |
Процесс гидролиза солей в ряде случаев может быть очень сложным. Поэтому простые уравнения реакции гидролиза в общепринятой записи часто являются условными. [7]
Процесс гидролиза солей с образованием многоядерных комплексов протекает во времени, для установления равновесия иногда требуется до нескольких десятков часов. В обычных условиях ( по крайней мере, в лаборатории) зачастую используют заранее приготовленные растворы, возраст которых не контролируется и которые поэтому могут содержать ионы разной степени полимеризации, что также может оказывать влияние на дисперсность образующихся частиц. В качестве примера влияния возраста раствора на размер частиц образующегося осадка можно привести работу [148], в которой показано, что размер частиц BaSCU зависит от возраста исходного раствора ВаС12: с увеличением возраста раствора ВаСЬ дисперсность частиц BaSO4 и, следовательно, число их в единице объема уменьшается и затем становится постоянным. [8]
 |
Зависимость степени гидролиза г водного раствора [ Cr ( H2O s ] Cl3 от температуры t ( C. [9] |
Процесс гидролиза солей в ряде случаев может быть очень сложным. Поэтому простые уравнения реакции гидролиза в общепринятой записи являются в общем случае условными. [10]
Процесс гидролиза солей количественно может быть охарактеризован с помощью двух величин: степени гидролиза h и константы гидролиза / Сгндр. [11]
Процесс гидролиза солей циркония в растворах подчиняется общим закономерностям. Гидролиз галогенидов циркония прогрессирует во времени и углубляется с повышением температуры. На гидролиз циркония заметно влияет природа кислоты. [12]
Количественно процесс гидролиза солей может быть охарактеризован с помощью степени гидролиза h и константы гидролиза / Сг. Большое влияние на степень гидролиза оказывают температура и концентрация. Чем выше температура и чем больше разбавлен раствор водой, тем больше степень гидролиза. Это связано с тем, что с увеличением температуры степень диссоциации воды возрастает, вследствие чего резко возрастает концентрация ионов Н и ОН -, а поэтому равновесие гидролиза смещается вправо. [13]
 |
Характер среды в растворе в зависимости от типа гидролизующеися соли. [14] |
Количественно процесс гидролиза солей может быть охарактеризован с помощью степени гидролиза h и константы гидролиза / Ср. Степенью гидролиза соли называют отношение ( в %) числа гидролизованных молекул к общему числу растворенных молекул. Большое влияние на степень гидролиза оказывают температура и концентрация. Чем выше температура и чем больше разбавлен раствор водой, тем больше степень гидролиза. Это связано с тем, что с увеличением температуры степень диссоциации воды возрастает, вследствие чего резко возрастает концентрация ионов Н и ОН, а поэтому равновесие гидролиза смещается вправо. [15]
Страницы: 1 2 3 4