Катодный процесс - разряд
Cтраница 1
Катодный процесс разряда и выделения водорода был детально исследован, особенно школой акад. Общая реакция катодного разряда водорода 2H - t - 2e - - H2 представляет собой ряд последовательно связанных стадий. Установлено, что в большинстве случаев стадией, наиболее тормозящей общий процесс, для многих металлов является передача заряда. Только для некоторых металлов с низким перенапряжением водорода - платины и палладия - основной тормозящей стадией может быть рекомбинация атомов водорода или их электрохимическая адсорбция. Остальные ступени, как, например, концентрационная поляризация ( затруднение в подводе ионов водорода к электроду и отвод атомов или молекул водорода) вследствие большой подвижности ионов водорода и возможности его выделения в виде пузырьков газа, оказывают незначительное торможение, особенно, если процесс происходит в кислой среде. [1]
Для определения скорости катодного процесса разряда ионов водорода по количеству выделившегося в процессе коррозии водорода капсулу помещают в вакуумиррванную систему. В этом случае она является и образцом, и своеобразным автоклавом. [2]
Скорость этого процесса ограничивается замедленностью катодного процесса разряда ионов водорода вследствие очень высокого перенапряжения. Примеси ( медь, железо, сурьма, никель), обычно присутствующие в техническом цинке, обладают меньшим водородным перенапряжением. По отношению к цинку эти металлы являются катодами, поскольку их потен-6 7 т, час циалы менее отрицательны. В результате этого скорость саморастворения цинка заметным образом возрастает по мере того, как содержание примесей увеличивается. Целью работы является сравнение скоростей коррозии технического цинка и химически чистого. [3]
Скорость этого процесса ограничиваается замедленностью катодного процесса разряда ионов водорода вследствие очень высокого перенапряжения. Примеси ( медь, железо, сурьма, никель), обычно присутствующие в техническом цинке, обладают меньшим водородным перенапряжением. По отношению к цинку эти металлы являются катодами, поскольку их потенциалы менее отрицательны. В результате этого скорость саморастворения цинка заметным образом возрастает по мере того, как содержание примесей увеличивается. [4]
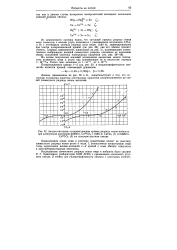 |
Анодно-катодные поляризационные кривые разряда ионов кобальта. [5] |
Из приведенного примера видно, что катодный процесс разряда ионов меди совместно с ионами ртути начинается с равновесного потенциала 0 76 в, а не с потенциала начала разряда иона меди ( 0 69 в), зафиксированного при: снятии поляризационной кривой ( см. рис. 30), как это обычно принято считать. Графики зависимостей, показанные на рис. 31, подтверждают схематическое изображение явлений совместного разряда, сделанное на основании. [6]
Из этих данных следует, что при замене катодного процесса разряда ионов водорода процессом восстановления ионов Си2 до Си или восстановления иона Hg2 до металлической ртути теоретическое напряжение разложения понижается. Однако величины термодинамически обратимых электродных потенциалов и теоретического напряжения разложения не определяют однозначно величину напряжения на ячейке. Она зависит также от перенапряжения для анодного и катодного процесса, от состава, концентрации, электропроводности и температуры электролита, а также от конструкции электролизера. Нормальный потенциал разряда ионов никеля более электроотрицателен, чем ионов водорода, однако из-за влияния перечисленных факторов, прежде всего высокого перенапряжения выделения водорода, процесс электролиза хлористого никеля можно проводить при более низком напряжении на ячейке, чем прямой электролиз соляной кислоты. [7]
Однако наблюдающаяся обычно разница в выходах по току для катодного процесса разряда ионов щелочного металла и для анодного процесса его ионизации из амальгамы, а также другие трудности, встретившиеся при практическом использовании биполярного амальгамного электрода, задерживают реализацию этих предложений. [8]
Другая серия опытов была проведена Н. А. Изгарышевым и Е. Я. Майоровой по изучению влияния нейтральных солей на катодный процесс разряда ионов кадмия. [9]
Таким образом, анализ катодных поляризационных кривых показывает, что добавки уротропина вызывают торможение катодного процесса разряда водородных ионов. [10]
Левая часть этого равенства представляет общую скорость процессов анодного направления, правая часть выражает скорость катодных процессов разряда водородных ионов и собственных ионов металла. [11]
Левая часть этого равенства представляет общую скорость процессов анодного направления, правая часть выражает скорость катодных процессов разряда водородных ионов и собственных ионов металла. [12]
Субпотенциальное осаждение атомов металла: за счет энергии взаимодействия разрядившихся адсорбированных атомов металла с чужеродной подложкой катодный процесс разряда ограниченного количества ионов металла с образованием адато-мов возможен при потенциалах, более положительных, чем равновесный потенциал данной системы и потенциал стационарного осаждения металла. [13]
 |
Анодные поляризационные кривые. [14] |
Логарифмическая зависимость электрохимической поляризации от плотности тока при достаточно больших значениях последней была впервые установлена Тафелем для катодного процесса разряда водородных ионов ( 1900 г.), и уравнение подобного типа называют уравнением Тафеля или тафелевским. [15]
Страницы: 1 2