Катодный процесс - разряд
Cтраница 2
 |
Полная кривая катодной поляризации при электрохимическом восстановлении кислорода. [16] |
После того как на кривой концентрационной поляризации кислородного электрода достигается предельный ток, потенциал резко падает до значений, соответствующих началу второго катодного процесса разряда водородных ионов из раствора. [17]
Теория замедленного разряда приложима ко всем электрохимическим процессам с замедленной электрохимической стадией разряда или ионизации и изложена выше ( см. с. Именно при изучении катодного процесса разряда водородных ионов и его поляризации складывались основные положения электрохимической кинетики электродных процессов. [18]
Поэтому при высоких частотах торможение катодного процесса разряда ионов водорода значительно меньше, чем при низких частотах. [19]
 |
Поляризационные кривые. [20] |
Введение ингибитора в раствор может привести к задержке скорости катодного процесса разряда ионов водорода на поверхности металла. В случае введения другого ингибитора торможению подвергается анодная стадия ионизации металла. Очень часто действие ингибитора одновременно направляется на обе стадии коррозионного процесса. [21]
Введение ингибитора в раствор может привести к задержке скорости катодного процесса разряда ионов водорода на поверхности металла. В случае введения другого ингибитора торможению подвергается анодная стадия ионизации. Очень часто действие ингибитора одновременно направляется на обе стадии коррозионного процесса. Пунктиром на этом рисунке показаны кривые ка-тодной п анодной поляризации в полулогарифмических координатах для чистого неингибированного раствора кислоты. Сплошными линиями на рисунке показаны поляризационные кривые, относящиеся к ингибированному раствору. Абсцисса точки пересечения обеих кривых по-прежнему определяет скорость саморастворения металла i c, но на этот раз в присутствии ингибитора в растворе. [22]
Другой важный вывод, вытекающий из этих исследований, состоит в том, что ряд металлов, расположенных по возрастанию перенапряжения ионизации кислорода при постоянной плотности тока ( например, равной половине предельного диффузионного), не совпадает с таковым для металлов, расположенных по возрастанию водородного перенапряжения. Иными словами, металлы ведут себя неодинаковым образом по отношению к ( катодному процессу разряда ионов водорода и электрохимическому восстановлению кислорода. [23]
При этом, наряду с катодным процессом разряда ионов цинка, протекал, хотя и с меньшей скоростью, анодный процесс ионизации цинка, мерой скорости которого является нарастание активности раствора. [24]
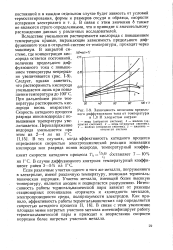 |
Зависимость величины предельного диффузионного тока от температуры в 1 0 Н хлористом натрии. [25] |
Вследствие уменьшения растворимости кислорода с повышением температуры кривые, выражающие зависимость предельного диффузионного тока в открытой системе от температуры, проходят через максимум. Следует, однако заметить, что растворимость кислорода уменьшается лишь при повышении температуры до 100 С. При дальнейшем росте температуры растворимость кислорода вновь возрастает. Скорость катодного процесса разряда ионов водорода с повышением температуры увеличивается. Перенапряжение водорода уменьшается при этом на 2 - 4 мв на ГС. [26]
В этом случае до рН - Ч скорость анодного процесса, в частности величина потенциала пробоя, определяется концентрацией не ионов водорода, а ионов хлора. Если в нейтральных деаэрированных средах на анодных поляризационных кривых стали 1Х18Н9Т отсутствует область активного растворения, то в средах с более низким рН сталь при тех же значениях потенциалов начинает растворяться в активном состоянии. В соответствии с изложенным в растворах азотной кислоты с рН 2 - 3 скорость коррозии стали 1Х18Н9Т практически не отличается от скорости ее в дистиллированной воде. Это объясняется тем, что с увеличением скорости катодного процесса разряда ионов водорода потенциал стали смещается в положительную сторону, что в соответствии с ходом анодной поляризационной кривой ( см. рис. 111 - 13 и 111 - 14, кривая 4) приводит к увеличению скорости коррозионного процесса. [27]
На рис. 40 слева изображены парциальные кинетические кривые электрохимических процессов, протекающих с участием ионов металла и Н - ионов на сложном электроде. Вверх по оси ординат отложены более отрицательные значения потенциала. Поэтому равновесный потенциал в системе металл - ионы металла располагается выше, а равновесный потенциал во второй окислительно-восстановительной системе, в которой участвуют водород и Н - ионы, находится несколько ниже. Налево от оси ординат отложены значения скорости анодного процесса ионизации металла и водорода, направо - скорость катодных процессов разряда ионов металла и вода-рода. Сплошные линии, проведенные через точки равновесных потенциалов в обеих системах изображают поляризационные кривые, характеризующие зависимость потенциала металла и водородного электрода от внешнего тока. [28]
Железо, никель и в меньшей степени хром увеличивают коррозионную стойкость циркония, задерживая наступление стадии ускоренной коррозии как в воде, так и в паре. В том случае, когда цирконий загрязнен азотом, углеродом или другими вредными примесями, железо, никель и хром сообщают ему меньшую коррозионную стойкость, чем олово. Увеличение суммарной концентрации этих элементов в сплаве свыше 0 5 % приводит к ухудшению его коррозионной стойкости. В значительной степени стойкость сплавов, легированных железом и никелем, зависит от термообработки и структуры металла. Сплавы, легированные до 2 % железом, никелем и хромом порознь или в сочетании друг с другом, имеют более высокую коррозионную стойкость в водяном паре при температуре 400 - 815 С, чем кристаллический прутковый цирконий. Последнее обстоятельство позволяет предполагать, что указанные легирующие компоненты действуют в данном случае как эффективные катодные присадки. Увеличение скорости катодного процесса при введении в цирконий этих металлов приводит к смещению стационарного потенциала в положительную сторону. При этом стацио1 парный потенциал смещается в область пассивации и скорость коррозионного процесса соответственно уменьшается. По данным М. Е. Страуманиса [111,240], введение в плавиковую кислоту ионов платины приводит к пассивации циркония. Это еще раз подтверждает, что легирующие компоненты - железо и никель можно рассматривать как эффективные катодные присадки. Следовательно, скорость катодного процесса разряда ионов водорода увеличивается при легировании циркония железом и никелем. Характер окисной пленки в этом случае, видимо, не является решающим в определении коррозионной стойкости циркония. [29]
Страницы: 1 2