Электрохимический процесс - коррозия
Cтраница 3
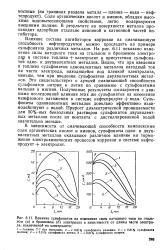 |
Влияние сульфонатов на изменение силы катодного тока на стальном ( а и бронзовом ( б электродах в зависимости от длины части электрода, извлеченной из электролита. [31] |
В зависимости от смачивающей способности комплексные соли органических кислот и аминов, сульфонаты одно - и двухвалентных металлов оказывают различное влияние на торможение электрохимических процессов коррозии в системе нефтепродукт электролит. [32]
При повышении температуры или снижении давления избыток растворенного кислорода выделяется из нефтепродукта и вступает в контакт с поверхностью технических средств, вызывая тем самым электрохимический процесс коррозии металла. G понижением температуры или повышением давления нефтепродукты насыщаются кислородом из газового пространства. [33]
Скорость коррозии обычной углеродистой стали, широко применяемой на промышленных предприятиях, во многом зависит от среды и условий эксплуатации, в которых происходит электрохимический процесс коррозии оборудования. [34]
При повышении температуры или снижении давления избыток растворенного кислорода выделяется из нефтепродукта и вступает в контакт с поверхностью технических средств, вызывая тем самым электрохимический процесс коррозии металла. С понижением температуры или повышением давления нефтепродукты насыщаются кислородом из газового пространства. [35]
Эта сторона механизма зависит от содержания в составе растворителя водо - или водомаслорастворимых ингибиторов коррозии, которые обеспечивают быстродействие в момент нанесения и торможение электрохимического процесса коррозии при проникновении воды через дефекты в пленке, образовавшиеся после испарения растворителя. В механизме защитного действия составов групп МЛ-1 и МЛ-2 эти явления имеют первостепенное значение. Так, благодаря повышенной поверхностной активности пленкообразующие составы НГ-222Б, автоконсервант мовиль, НГМ-МЛ тормозят развитие коррозионного процесса даже под пленкой лакокраски. [36]
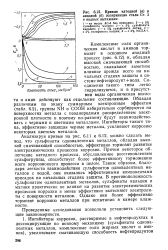 |
Кривые катодной ( о и анодной ( б поляризации стали Ст. 3 в водных вытяжках. [37] |
Анализируя кривые на рис. 6.11 и 6.12, можно сделать вывод, что сульфонаты одновалентных металлов, обладая высокой смачивающей способностью, эффективно тормозят развитие электрохимических процессов коррозии. Причем некоторое облегчение катодного процесса, обусловленное восстановлением сульфогруппы, способствует более эффективному торможению всего коррозионного процесса в целом. [38]
При повышении температуры или снижении парциального давления избыточное количество растворенного кислорода выделяется из нефтепродукта и вступает в контакт с поверхностью технических средств, вызывая тем самым электрохимический процесс коррозии металла. С понижением температуры или повышением парциального давления нефтепродукты насыщаются кислородом из газового пространства. [39]
Калиненко [28] обнаружил колонии бактерий на алюминиевых, латунных и бронзовых пластинках, погруженных в натуральную морскую воду, и высказал предположение, что эти колонии ускоряют электрохимические процессы коррозии металлов. Розенберг и Улановский [29] установили, что бактерии могут усиливать коррозию нержавеющей стали в морской воде, уменьшая защитные эффекты катодной поляризации, но могут и замедлять коррозию, способствуя образованию осадка СаС03 и Mg ( OH) 2 на поверхности стали. [40]
Коррозия стали в воде и водных растворах солей, т.е. в нейтральных средах со значением рН, равным 5 - - 9, происходит в присутствии кислорода; электрохимический процесс коррозии протекает с кислородной деполяризацией. [41]
 |
Схема проникновения молекул воды через различные покрытия. [42] |
Защитные свойства лакокрасочного покрытия во многом зависят от ингибирующего защитного действия пигментов, входящих в состав этого покрытия; например, свинцовый сурик обладает защитными свойствами благодаря наличию окиси свинца, которая тормозит развитие электрохимического процесса коррозии вследствие образования на поверхности железа гидрата закиси железа. [43]
Наличие механических примесей в добываемой продукции, особенно кварцевого песка, способствует усилению гидромониторного воздействия жидкости на поверхность металла, в том числе разрушению накапливающихся гидроокйсных и окисных пленок, что, в свою очередь, интенсифицирует электрохимический процесс коррозии. [44]
Из табл. 5 видно, что добавки как водорастворимого ингибитора ( катапин А), так и углеводородных ингибиторов ( диамин - диолеат, кальциевая соль СБ-3 и окисленный петролатум, пикон и др.) при комнатной и повышенной температурах сильно тормозят электрохимический процесс коррозии стали в смеси из водного и углеводородного конденсатов. [45]
Страницы: 1 2 3 4