Электрохимический процесс - окисление
Cтраница 1
Электрохимический процесс окисления, как правило, является не единственным при электролизе и всегда сопровождается анодным выделением кислорода. Следовательно, расход электрической энергии распределяется между этими двумя процессами. Преобладание одного из них зависит от величин потенциала окисления вещества и потенциала выделения кислорода, причем преобладать будет тот процесс, который идет более легко, при меньшем потенциале. [1]
Электрохимический процесс окисления, как правило, является не единственным при электролизе, но всегда сопровождается анодным выделением кислорода, и, таким образом, энергия распределяется между двумя процессами. [2]
В замкнутой гальванической цепи электрохимические процессы окисления и восстановления протекают самопроизвольно. [3]
Электрический программатор предназначен для изучения электрохимических процессов окисления и восстановления. Он имеет два потенциостата для задания потенциала на два ИЭ относительно общего ЭС. В приборе реализована методика измерения редокс-потенциалов и предельного тока, основанная на регистрации квантов ЭХЛ, возникающих во время окислительно-восстановительных процессов. Этот прием позволяет исключить воздействие электрических шумов на аналитический сигнал и приводит к улучшению отношения сигнал: помеха, а следовательно, и повышению чувствительности прибора. Процесс измерения в комплексе автоматизирован. [4]
Электрический программатор предназначен для изучения электрохимических процессов окисления и восстановления. Он имеет два потенциостата для задания потенциала на два ИЭ относительно общего ЭС. В приборе реализована методика измерения редокс-потенциаловч и предельного тока, основанная на регистрации квантов ЭХЛ, возникающих во время окислительно-восстановительных процессов. Этот прием позволяет исключить воздействие электрических шумов на аналитический сигнал и приводит к улучшению отношения сигнал: помеха, а следовательно, и повышению чувствительности прибора. Процесс измерения в комплексе автоматизирован. Диапазон скоростей и амплитуд РН программатора составляют соответственно от 1 до 1000 мВ / с; от О 5 и от 0 до - 5 В. [5]
Задачей настоящей работы является обнаружение образования ионов галлия промежуточной валентности при электрохимическом процессе окисления его с целью непосредственного доказательства стадийного протекания этого процесса. [6]
На большинстве обычных электродов при пропускании тока через границу раздела электрод - раствор протекают электрохимические процессы окисления или восстановления. Так, на электродах из металлов, погруженных в растворы солей, содержащих катионы металла, идут процессы выделения или растворения металла электрода. Потенциал таких электродов при прохождении через них постоянного тока практически не меняется, а ток целиком расходуется на электрохимические реакции. Электроды, потенциал которых при пропускании через них постоянного тока практически не меняется, называются неполяризуемыми. К неполяризуемым электродам относятся, в частности, медь, серебро, кадмий, ртуть и другие металлы в растворе собственной соли. [7]
Другое технологическое направление - электрохимическая обработка, осуществляемая наложением электрического поля и непрерывным столкновением минеральных частиц друг с другом, в результате чего протекают электрохимические процессы окисления - восстановления. Указанное направление возникло и получило практическое применение в СССР с 1968 г. и продолжает развиваться. [8]
Исследование процесса адсорбции и окисления муравьиной кислоты показывает, что уже при работе на гладком платиновом электроде мы часто сталкиваемся с наложением на собственно электрохимический процесс окисления каталитического процесса разложения муравьиной кислоты. [10]
Во всех случаях при схематическом изображении электрохимических ячеек ( вне зависимости от того, гальванические ли они или электролитические) левосторонним полуэлементом должен быть тот, в котором протекает электрохимический процесс окисления, а правосторонним тот, в котором идет процесс электровосстановления. [11]
На большинстве обычных электродов при пропускании тока через границу раздела электрод - раствор протекают электрохимические процессы окисления или восстановления. Так, на электродах из металлов, погруженных в растворы солей, содержащих катионы металла, идут процессы выделения или растворения металла электрода. Потенциал таких электродов при прохождении через них постоянного тока практически не изменяется, а ток целиком расходуется на электрохимические реакции. Электроды, потенциал которых при пропускании через них постоянного тока практически не меняется, называют неполяризуемыми. К неполяризуемым электродам относятся медь, серебро, кадмий, ртуть и другие металлы в растворе собственных солей. [12]
Выяснение детального механизма электродных реакций необходимо для рационального управления течением электрохимических реакций. Рассмотрение экспериментального материала, полученного различными методами для указанных типов реакций электрохимического окисления, приводит к заключению, что, наряду с величиной и характером распределения электрического поля, существенным фактором, определяющим механизм, скорость и селективность электрохимического процесса окисления, являются поверхностные анионные ( кислородные) соединения, природа которых зависит от вещества и потенциала электрода, и состава раствора. Нахождение путей эффективного воздействия на характер и свойства поверхностных электродных соединений представляет важный путь рационального управления электрохимическим процессом для получения оптимального выхода заданных продуктов электролиза в сложном электрохимическом процессе. [13]
Потеря электрона с образованием катион-радикала требует сравнительно больших энергетических затрат. В работе142 при электрохимическом окислении фуллеренов были обнаружены положительно заряженные частицы, образование которых сопровождалось протеканием чисто химических процессов. При этом электрохимический процесс окисления частично был необратим. Окисление сопровождается образованием эпоксида, но при этом структура молекулы фуллерена не разрушается. [14]
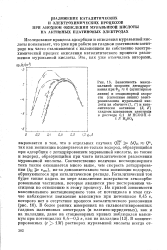
В близки как по форме, так и по протяженности. Предположительно совокупность указанных фактов может быть объяснена участием в анодном процессе водорода, образовавшегося при взаимодействии СО с водой на катализаторе. Таким образом, можно сделать заключение, что основной электрохимический процесс окисления окиси углерода происходит на платине. Механический контакт сульфида молибдена с платиной приводит к увеличению сорбционной способности последней, так как сам сульфид молибдена, судя по кривым заряжения, практически не адсорбирует СО. Кроме того, на композиции Pt MoS2 процесс электроокисления СО происходит при более низких анодных потенциалах, чем на платине, что, возможно, связано с более сложным протеканием процесса. [15]
Страницы: 1 2