Электрохимический процесс - восстановление
Cтраница 1
Электрохимический процесс восстановления и окисления упрощенно представляется как последовательное соединение активационного сопротивления с импедансом поляризации. Поляризационное сопротивление включает сопротивление и емкость. Активационное сопротивление характеризует процесс восстановления ( окисления), его обратимость, поляризационный импеданс - процесс диффузии. [1]
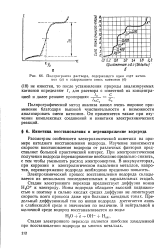 |
Подпрограмма раствора, содержащего один сорт катионов ( а и содержащего смесь катионов ( б. [2] |
Электрохимический процесс восстановления водорода складывается из нескольких последовательных и параллельных стадий. [3]
Установлено, что электрохимический процесс восстановления Rb и Cs протекает квазиобратимо, Na и К - - обратимо, a Li - / необратимо. [4]
В катодном полуэлементе электрохимический процесс восстановления молекул воды в гидроксильные ионы и биохимический процесс превращения сульфатных ионов под действием бактерий протекают одновременно. Бактерии Desulfovibrio desulforicans, восстанавливая в католите ионы сульфата в ионы сульфида по биохимическому механизму, играют роль агентов переноса электронов па поверхность катода. [5]
Образование медной накипи обусловлено электрохимическим процессом восстановления меди из ее соединений, вносимых в котел с питательной водой. На участках с высоким локальным тепловым напряжением возможно нарушение целостной защитной оксидной пленки металла, и на поверхности металла появляются электропары. Вследствие наличия местной разности потенциалов между отдельными участками поверхности нагрева происходит процесс превращения ионов меди в металлическую медь с осаждением ее на металле. [6]
По-видимому, в отличие от чисто электрохимических процессов восстановления или окисления органических соединений, протекающих лучше всего - при потенциалах, близких к нулевой точке электрода, для проведения аналогичных реакций в присутствии ката-лизаторов-переиосяиков нужно подбирать другие условия. [7]
Влияние радиуса катионов фона на скорость электрохимических процессов восстановления впервые было исследовано в работах Герасименко и Слендика [1] и Н. А. Изгарышева и X. Герасименко и Слендик при изучении влияния катионов щелочных и щелочноземельных металлов на восстановление водорода нашли, что скорость выделения водорода в присутствии хлоридов щелочных металлов при переходе от лития к цезию уменьшается примерно в полтора раза. Такого же рода эффекты описаны в работах Н, А. [8]
Следовательно, основной причиной образования накипей является электрохимический процесс восстановления меди, протекающий в зонах максимальных тепловых нагрузок, где под влиянием мощного теплового потока нарушена цельность защитной окисной пленки. В результате этого между отдельными участками металла создается местная разность потенциалов, которая может оказаться достаточной, чтобы стал протекать процесс электролитического выделения меди при данной концентрации ее ионов в котловой воде. Так как образующаяся медная накипь обладает хорошей электропроводностью, наличие ее на поверхности нагрева не является существенной помехой для продолжения электрохимических процессов, в результате которых выделяются новые порции металлической меди. [9]
Вследствие расхода ионов водорода при протекании многих электрохимических процессов восстановления величина рН в при-электродном пространстве может заметно повыситься по сравнению с ее значением в массе раствора. С возможностью обеднения приэлектродного пространства донорами протонов особенно следует считаться в случае электродных процессов, на характер протекания которых оказывает влияние рН раствора. Поэтому такие процессы следует проводить в хорошо забуференных растворах, в которых концентрация действующего кислотного компонента должна быть по меньшей мере в несколько раз больше, чем величина произведения концентрации деполяризатора и числа ионов водорода v, участвующих в электродном процессе. [10]
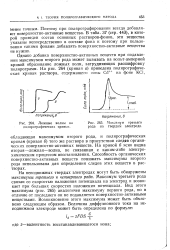 |
Ложные волны на полярографических кривых.| Максимум третьего рода на твердом электроде. [11] |
На кривой б ясно видна вторая-ложная-волна, не связанная с каким-либо электрохимическим процессом восстановления. Способность органических поверхностно-активных веществ понижать максимумы второго рода использована для определения следов этих веществ в растворах. [12]
При разряде окисноникелевого и окисномарганцового электродов наблюдается поляризация, обусловленная наличием кинетической задержки в течении самого электрохимического процесса восстановления окислов. [13]
 |
Зависимость температуры стенки трубы экрана от толщины слоя накипи для различных значений ее теплопроводности. [14] |
Медные накипи в котлах образуются при наличии в питательной воде продуктов коррозии латунных труб различных теплообменников и являются следствием электрохимического процесса восстановления меди в условиях разрушения защитной оксидной пленки. [15]
Страницы: 1 2 3