Электрохимический процесс - восстановление
Cтраница 2
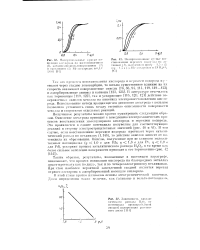
Эти исследования убеждают, что образование поверхностных дырочных комплексов для твердых растворов ТО должно происходить по схемам (5.V) и (5.VI), следовательно, для представления механизма электрохимического процесса восстановления кислорода необходимо исходить из этих структур. [16]
Причин релаксадии потенциала к исходному значению может быть несколько: снижение Приэлектродной концентрации ионов Ag за счет их отвода от электрода в объем раствора; протекание побочного электрохимического процесса восстановления кислорода, образования оксида; необратимая адсорбция катионов Ag, сопровождающаяся полным или частичным переносом заряда на поверхности сплава с образованием монослоев ад-атомов серебра; увеличение поверхностной активности серебра в сплаве. [17]
В литиевых источниках тока с твердыми окислителями применяются MnO2, Ag2Cr04, CuS, CuO, FeS, FeS2, Bi2O3, V205 и др. Общим свойством этих элементов является малое значение допустимой плотности тока разряда - не более 2 мА / см2, что обусловлено замедленностью электрохимических процессов восстановления твердых окислителей в апротонных растворителях. [18]
Полученные результаты можно кратко суммировать следующим образом. Окисление электрода приводит к замедлению электрохимических процессов восстановления молекулярного кислорода и перекиси водорода. В том случае, если восстановление перекиси водорода протекает через каталитический распад по механизму (1.148), то действие окислов зависит от потенциала пх образования. [20]
Полученные результаты можно кратко суммировать следующим образом. Окисление электрода приводит к замедлению электрохимических процессов восстановления молекулярного кислорода и перекиси водорода. [22]
Потенциал свежезаряженного ОНЭ превышает потенциал обратимого кислородного электрода примерно на 0 2 в. При отсутствии поляризации саморазряд обусловливается электрохимическим процессом восстановления двуокиси никеля с одновременным протеканием компенсирующей реакции выделения кислорода на токо-подводе. [23]
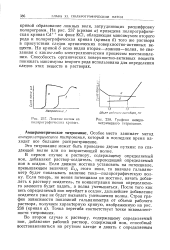 |
Ложные волны на полярографических кривых.| Графики амперо-метрического титрования. [24] |
На рис. 237 ( кривая а) приведена полярографическая кривая Cd 1 на фоне КС1, обладающая максимумом второго рода и полярографическая кривая ( кривая б) того же раствора в присутствии следов органических поверхностно-активных веществ. На кривой б ясно видна вторая-ложная-волна, не связанная с каким-либо электрохимическим процессом восстановления. Способность органических поверхностно-активных веществ понижать максимумы второго рода использована для определения следов этих веществ в растворах. [25]
При разряде элементов с гидратиро-ванной двуокисью марганца токами большой плотности наблюдается обычное твердофазное восстановление с образованием твердого раствора хМпСЬ - t / MnOOH. Гетеролит в этих условиях не образуется, так как при слишком быстром подщелачивании доля электрохимического процесса восстановления гидратирован-ной двуокиси марганца до двухвалентного марганца становится ничтожной. Отсутствие достаточного количества ионов двухвалентного марганца делает невозможным протекание вторичного процесса образования гетеролита. [26]
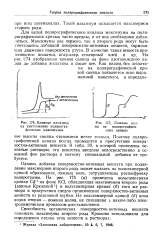 |
Влияние желатина на уничтожение полярографических максимумов.| Ложные волны на полярографиче ских кривых. [27] |
Однако, добавка поверхностно-активных веществ при подавлении максимумов второго род а может вызвать на вольтамперной кривой образованиег ложных волн, затрудняющих расшифровку полярограмм. На рис. 175 ( а) приведена вольтамперная кривая СсТ на фоне КС1, обладающая максимумом второго рода ( данные Крюковой1) и вольтамперная кривая ( б) того же раствора в присутствии следов органических поверхностно-активных веществ из резиновой трубки. На вольтамперной кривой ( б) ясно видна вторая - ложная волна, не связанная с каким-либо электрохимическим процессом восстановления. [28]
Попытки автора представить положительные электроды свинцового и железо-никелевого аккумуляторов как типичные окислительно-восстановительные системы основаны на устаревших представлениях об электродных процессах. Например, растворимость четырехвалентного свинца в серной кислоте обычных для аккумулятора концентраций исчезающе мала, и образование четырехвалентного иона в растворе не может быть промежуточной стадией реальных процессов на электроде. Двуокись свинца, так же как № 2О3, надо рассматривать как электрод, аналогичный металлическим электродам, на поверхности которого при разряде происходит электрохимический процесс восстановления его вещества до иона низшей - валентности, который уходит в раствор и затем выпадает в виде соли в, осадок. Достаточно большая растворимость сульфата свинца, как и другие факты, хорошо подтверждают эту теорию, развитую в основном советскими учеными. [29]
 |
Электроли - [ IMAGE ] Ртутный [ IMAGE ] Твердый ин-тическая ячейка капающий электрод дикаторный электрод. [30] |
Страницы: 1 2 3