Окислительно-восстановительный процесс
Cтраница 1
Окислительно-восстановительные процессы связаны с переносом электронов и - сопровождаются изменением степени окисления участвующих в них элементов. Окислитель, восстанавливаясь, переходит в сопряженную с ним восстановленную форму, и, наоборот, восстановитель, окисляясь, переходит в сопряженную с ним окисленную форму. Возможность, направление и интенсивность электронного переноса ( окислительно-восстановительной реакции) определяются величинами окислительно-восстановительных потенциалов Е реагирующих пар. [1]
Окислительно-восстановительные процессы на той или иной стадии анализа в сочетании с реакциями осаждения, растворения, Еамплексообразовайия лежат в основе всех схем систем этического анализа. Наконец, реакции окисления-восстановления часто используют для переведения в раствор мало-растворимых соединений, сплавов, природных объектов. [2]
Окислительно-восстановительные процессы нами во всем курсе трактуются с точки зрения электронной теории. [3]
Окислительно-восстановительные процессы сопровождаются оттягиванием или перемещением части или всех валентных электронов от ионов, атомов или молекул одного из веществ, вступающих в реакцию, к частицам другого реагирующего вещества. В окислительно-восстановительных реакциях одновременно, взаимосвязанно протекают два процесса: окисление и восстановление. Окисление связано с отдачей электронов отдельными атомами или группой атомов. Восстановление заключается в присоединении электронов отдельными атомами или группой атомов. Те атомы, ионы или молекулы, которые отдают электроны, называются восстановителями. Атомы, ионы или молекулы, которые присоединяют электроны, называются окислителями. В процессе окислительно-восстановительной реакции восстановитель окисляется, а окислитель восстанавливается. [4]
Окислительно-восстановительный процесс проходит не только при взаимодействии двух или нескольких веществ, но при определенных условиях и между атомами одного вещества-в так называемых реакциях диспропорциониро-вания. При этих реакциях из исходного вещества получаются соединения, в одном из которых атомы имеют более высокое, а я другом - более низкое окислительное число по сравнению с первоначальным. [5]
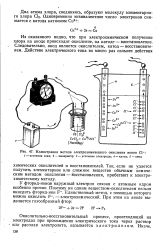 |
Иллюстрация метода электрохимического окисления ионов С1. У - источник тока. 2 - амперметр. 3 - угольные электроды. 4 - катод. 5 - анод. [6] |
Окислительно-восстановительный процесс, происходящий на электродах при прохождении электрического тока через раствор или расплав электролита, называется электролизом. [7]
Окислительно-восстановительные процессы в гетерогенной системе редоксит - раствор в общем случае сопровождаются прото-литическими реакциями и перераспределением ионов между фазой редоксита и водной фазой. Поэтому свойства редоксита нельзя рассматривать в отрыве от свойств равновесного с ним водного раствора. Приводя значение кажущегося стандартного окислительного потенциала редоксита, необходимо указывать рН, ионную силу и состав солевого фона равновесного с редокситом водного раствора. [8]
Окислительно-восстановительные процессы между NO, NOz и бихроматом калия в присутствии мочевины в процессе разложения ею азотистой кислоты не протекают. [9]
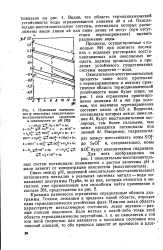 |
Изменение потенциалов ф некоторых окислительно-восстановительных процессов в зависимости от рН. [10] |
Окислительно-восстановительные процессы чаще всего протекают с перенапряжением и поэтому практически область термодинамической устойчивости воды будет шире; на рис. 1 она ограничена ориентировочно линиями Ы и тп при условии, что величина перенапряжения составит около 0 5 в. [11]
Окислительно-восстановительные процессы, протекающие с участием ЭЙ, обычно рассматривают как диффузионные. Николаев, исходя из теоретических соображений о вероятных соотношениях концентраций и коэффициентов диффузии поглощаемого вещества в твердой и жидкой фазах, исключает возможность контролирования кинетики окислительно-восстановительных процессов в ЭЙ пленочной диффузией. [12]
Окислительно-восстановительные процессы очень часто осложняются процессами комплексообразования. При этом введение веществ, дающих комплексное соединение с одним из исходных участников равновесия, сдвигает окислительно-восстановительное равновесие влево, тогда как участие в комплексообразовании одного из продуктов реакции ведет к сдвигу равновесия вправо. [13]
Окислительно-восстановительные процессы оказывают большое влияние на почвообразовательный процесс и плодородие почв. [14]
Окислительно-восстановительные процессы, связанные с обменом электронов, широко встречаются в организме, в частности в дыхательных ферментативных системах, содержащих гемин, железо которого, окисляясь, переходит из двухвалентного в трехвалентное и наоборот. Этот окислительно-восстановительный процесс может происходить и в более простых системах, когда, например, хлорное железо обратимо переходит в хлористое и наоборот. [15]
Страницы: 1 2 3 4