Автокаталитический процесс
Cтраница 1
Автокаталитические процессы наблюдаются также при восстановлении анионов нитрата. Продуктом реакции, ускоряющим электродный процесс, в данном случае являются ионы гидроксила, которые, взаимодействуя с поливалентными катионами, повышают их каталитическую активность. Механизм этого процесса еще не выяснен. [1]
Эти автокаталитические процессы требуют применения температур от ПО до 130 и достаточных давлений для работы в жидкой фазе. Таким образом, наиболее высокая температура, обеспечивающая максимальную скорость реакции, применяется в первых ступенях процесса, когда концентрация гидроперекиси еще низкая и ее разложение не имеет значения. При таких условиях ведения процесса эффективно используется высокая скорость, с которой реакция протекает до достижения указанной степени превращения, и подавляются побочные реакции, снижающие выход целевого продукта. [2]
Этот автокаталитический процесс не следует смешивать с автокаталитическим характером анодной реакции растворения вследствие подкисления среды на анодных участках. [3]
Этот автокаталитический процесс не следует смешивать с автокаталитическим характером анодной реакции растворения вследствие подкисления среды на fанодных участках. [4]
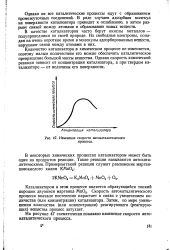 |
Изменение скорости автокаталитического процесса. [5] |
Скорость автокаталитического процесса вначале постепенно нарастает в связи с увеличением количества ( или концентрации) катализатора. Затем, по мере уменьшения количества ( или концентрации) реагирующего ( реагирующих) вещества процесс затухает. [6]
Развитие автокаталитического процесса до самовоспламенения даже в изотермических условиях наблюдается при протекании разветвленных цепных реакций, характеризуемых тем, что наряду с реакциями продолжения цепи в отдельных звеньях возникают такие химические процессы, в результате которых взамен одной активной частицы появляются, как минимум, две новые активные частицы. [7]
Развитие каталитических и автокаталитических процессов также носит циклический характер ( сопровождается регенерацией активного продукта), поэтому кинетика их подчиняется общим урав-нениям теории цепных процессов. Однако эти каталитические и автокаталитические реакции не следует смешивать с цепными. [8]
Развитие каталитических и автокаталитических процессов также носит циклический характер ( сопровождается регенерацией активного продукта), поэтому кинетика их подчиняется общим уравнениям теории цепных процессов. Однако эти каталитические и автокаталитические реакции не следует смешивать с цепными. [9]
В автокаталитическом процессе окисления в жидкой фазе смеси алканов и нафтенов, заключающиеся в составе большинства керосиновых фракций ( содержащих обычно 40 - 70 % нафтенов и GO-30 % алканов), начинают окисляться, в основном, при температурах выше 150 С. Чистые же алканы с тем же числом углеродных атомов в молекуле окисляются автокатали-тически при более низких температурах. Это, в частности, указывает ка то, что между кинетикой полного и частичного автоокисления углеводородов нет принципиального различия. [10]
Движущей силой автокаталитического процесса восстановления является окисление восстановителя, которое с достаточной интенсивностью протекает лишь на некоторых металлах с определенными каталитическими свойствами; поэтому скорость всего каталитического процесса нельзя регулировать так просто, как, например, силу тока при электрохимическом осаждении металла. В отсутствие автокатализа реакция восстановления если и протекает, то во всем объеме раствора и приводит к образованию порошкообразного металла. [11]
 |
Зависимость стандартных окислительно-восстановительных потенциалов восстановителей от рН раствора при 25 С. [12] |
Движущей силой автокаталитического процесса восстановления является окисление восстановителя, которое с достаточной интенсивностью протекает лишь на некоторых металлах с определенными каталитическими свойствами; поэтому скорость всего каталитического процесса нельзя регулировать так просто, как, например, силу тока при электрохимическом осаждении металла. В отсутствие автокатализа реакция восстановления если и протекает, то во всем объеме раствора и приводит к образованию порошкообразного металла. [13]
Существует множество подобных автокаталитических процессов, протекание которых зависит от легкости окисления субстрата комплексным ионом металла и возможности регенерации окисленной формы последнего кислородом воздуха. Еще одним примером реакций этого типа является катализ ионами Си ( II) авто-окисления аскорбиновой кислоты [32] ( гл. [14]
Полимеризация протекает как автокаталитический процесс, с небольшим периодом индукции. [15]
Страницы: 1 2 3 4