Гомогенно-каталитический процесс
Cтраница 1
Гомогенно-каталитический процесс схематически можно представить следующим образом. [1]
Гомогенно-каталитические процессы в газовой фазе встречаются редко, так как газообразные катализаторы почти неизвестны. [2]
Важнейшими природными гомогенно-каталитическими процессами являются: разложение стратосферного озона; окисление метана в тропо - и стратосфере; окисление различных органических веществ в природных водах; более двух тысяч химических превращений в живой клетке, ускоряемых биологическими катализаторами - ферментами. [3]
Скорость гомогенно-каталитического процесса возрастает с увеличением активности катализатора, повышением температуры, концентрации реагирующих веществ и катализатора; иногда она растет при перемешивании реагентов. [4]
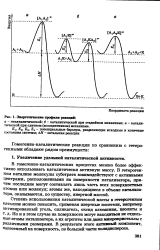 |
Энергетические профиля реакций. [5] |
В гомогенно-каталитических процессах можно более эффективно использовать каталитически активную массу. В гетерогенном катализе молекулы субстрата взаимодействуют с активными центрами, расположенными на поверхности катализатора, причем последние могут составлять лишь часть всех поверхностных атомов или молекул; атомы же, находящиеся в объеме катализатора, оказываются, по существу, инертной массой. [6]
Таким образом, исключительная роль гомогенно-каталитических процессов IB природе получает некоторое освещение. Живые системы используют гомогенные катализаторы в силу их способности приобретать широкий спектр каталитических функций почти при любом изменении состояния, вызванном эволюцией окружающей ореды. [7]
Отсюда вытекает и способ управления гомогенно-каталитическими процессами: ускорение процесса достигается увеличением концентрации катализатора и реагирующих веществ или повышением температуры системы, а замедление - обратными действиями. [8]
Реакция (2.1) моделирует ферментативный, а реакция (2.2) - обычный гомогенно-каталитический процесс, в котором невалентные ( сорбционные) взаимодействия между группами Е и R не реализуются. Для того чтобы решить, какой вклад в скорость ферментативного процесса вносит образование фермент-субстратного комплекса XE-RY, следует провести оценку скоростей химического процесса по первому и второму путям. [9]
С точки зрения создания аппаратов и технологических линий большой единичной мощности можно отметить, что, с одной стороны, как и для большинства гомогенно-каталитических процессов создание аппаратов большой единичной мощности затруднено из-за проблем организации контакта газа и жидкости при больших диаметрах аппаратов, с другой стороны, создание технологических линий большой единичной мощности возможно, поскольку работающие параллельно реакторы могут питать единую систему разделения. [10]
Хорошо известно, что всякий бесконечно разбавленный раствор является идеальным по отношению к растворителю. В обычно проводимых гомогенно-каталитических процессах концентрации катализаторов весьма малы, и поэтому все остальные вещества системы в сумме являются по отношению к катализатору растворителем в бесконечно разбавленном растворе. Поэтому в рассматриваемых системах катализатор не влияет на равновесие, а изменяет лишь скорость процесса. [11]
Присутствие окиси углерода под давлением 100 am препятствует разложению карбонила-кобальта на кобальт и карбонил, а присутствие водорода под давлением 100 am способствует тому, что из карбонила-кобальта вновь образуется карбонилгидрид кобальта. Таким образом в этом гомогенно-каталитическом процессе расходуется только водород. [12]
Интенсивные работы по активированию в гетерогенном катализе начались после того, как было показано, что активирование является мощным средством интенсификации ряда основных химических производств. Гомогенно-каталитические процессы начали внедряться в промышленность значительно позже и в основном во второстепенные, малотоннажные производства. Не случайно, что усиленный интерес к активированию гомогенно-каталитических процессов появился в последние одно-два десятилетия только тогда, когда было показано, какую роль они могут играть в ряде промыш-ленно важных процессов, при исследовании и моделировании биологических процессов, в аналитической химии и других областях. [13]
В развившемся процессе окисления скорости записанных выше стадий образования и расходования разных валентных форм катализатора равны, что приводит к стационарности концентрацией этих форм во время реакции. В большинстве случаев соль введенного катализатора ( соль двухвалентного кобальта или марганца) подвергается частичному или полному окислению ( рис. 5.5), сопровождающемуся изменением окраски раствора. Исследование кинетики гомогенно-каталитических процессов жидкофазного окисления показали, что скорость жидкофазного окисления реакции имеет дробную зависимость от концентрации катализатора. [15]
Страницы: 1 2