Дисротаторный процесс
Cтраница 2
Образование же ыс-мс-диенов происходит либо по термически запрещенному дис-рютаторному согласованному механизму, либо по несогласованному механизму. Из данных табл. 2 следует, что энергия активации для запрещенного по симметрии термического дисротаторного процесса примерно на 10 ккал / моль выше энергии активации разрешенного кон-ротаторного процесса ( ср. [16]
Эти диаграммы аналогичны диаграммам для реакций присоединения я-электронных систем ( разд. Диаграмма для кон-ротаторного процесса характеризует реакцию, разрешенную по симметрии, и диаграмма для дисротаторного процесса - реакцию, запрещенную по симметрии. [17]
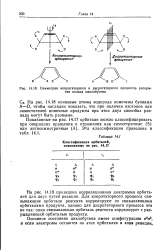 |
Симметрии конротаторного и дисротаторного процессов раскрытия кольца циклобутена. [18] |
На рис. 14.19 приведена корреляционная диаграмма орбита-лей для двух путей реакции. Для конротаторного процесса связывающие орбитали реагента коррелируют со связывающими орбиталями продукта, однако для дисротаторного процесса это не так: одна связывающая орбиталь реагента коррелирует с разрыхляющей орбиталью продукта. [19]
Имеются примеры электроциклических процессов, включающих и анионные частицы. Поскольку пентадиенил-анион является б я - электронной системой, его термическая циклизация в циклопентильный анион должна быть дисротаторным процессом. [20]
Можно привести много примеров фотохимического взаимного превращения циклобутен - бутадиен. В подавляющем большинстве случаев диены являются той частью циклической системы, в которой должен протекать разрешенный по симметрии дисротаторный процесс. [21]
При конротаторном механизме р2 - орбитали концевых групп атомов 1 и 4 будут перекрываться так, что между центрами 1 и 4 возникает узловая плоскость, тогда как при дисротаторном подобной плоскости возникать не будет. Следовательно, граничная орбиталь Ф2 такова, что при поворотах концевых групп связывающая молекулярная орбиталь может появиться лишь при дисротаторном процессе. [22]
Легко понять качественно смысл этого рисунка: слева направо исходная а-связывающая орбиталь простой связи повышается по энергии, две ее АО взаимодействуют все меньше и меньше друг с другом в ходе дисротаторного процесса; в то же самое время по мере возрастания я - компоненты этой первона-начально а-связывающей орбитали увеличивается ее взаимодействие с я-орбиталями остальной части молекулы, но только с теми, которые достаточно близки по энергии, имеют правильные узловые свойства ( симметрия), а также большие коэффициенты при атомах, соседних с атомами бывшей простой связи. Совершенно аналогичным образом первоначальная ст - разрыхляющая орбиталь уменьшается по энергии и отталкивает вниз те орбитали, которые имеют подходящие узловые свойства. Опять-таки в нашем случае имеется одна такая орбиталь, так как наша исходная я-система ( этилен) имеет всего только две я-орбитали. Связывающая я-орбиталь не имеет узла в области связи и пригодна для взаимодействия с вновь генерируемой к-компонентой первоначально связывающей or - комбинации, если раскрытие дисротаторное, и с я - компонентой первоначально разрыхляющей о - комбинации, если раскрытие конротаторное. Причины, по которым узловые свойства вновь образованных я - компонент исходных а - и ( Г - комбинаций противоположны для дисротаторного и конрота-торного раскрытия, становятся ясными из рис. 8 - 9, где показаны а - и а - комбинации АО повернутых метиленовых групп первоначальной 0-связи, а также их проекции в виде а - и гс-компонент. Аналогично, поскольку я - орбиталь этилена имеет узел в области связи, ее симметрия удовлетворяет условиям взаимодействия с первоначальной сг - комбинацией, если раскрытие дисротаторное, и с а-комбинацией, если оно конротаторное. Они изображены на рис. 8 - 8 светлыми линиями. В соответствии с этим уже чисто качественное рассмотрение узловых свойств исходных а - и ст - орбиталей разрывающейся связи и узловых свойств орбиталей я-системы в области ее взаимодействия с вновь образующимися АО позволяет сделать заключение, что раскрытие цикла в основном состоянии циклобутена разрешено при конротаторном движении и запрещена при дисротаторном. [23]
Однако, так как только одна орбиталь может коррелировать с / л, другая орбиталь должна переходить в разрыхляющую / 3-орбиталь. Сохранение орбитальной симметрии требует в этом случае высоколежащего переходного состояния, поэтому термическая реакция запрещена по симметрии. Очевидно, что в дисротаторном процессе с сохранением орбитальной симметрии затруднения вызывает fo - орбиталь - она не может переходить ни в одну связывающую орбиталь цикло-бутена. [24]
 |
Циклизация диметилгексатриена. [25] |
Аналогично можно проанализировать процессы циклоприсо-единения типа реакции Дильса - Альдера, если фиксировать плоскость отражения на всех стадиях реакции, как показано на рис. 14.20. Можно рассматривать этот процесс точно так же, как это было сделано для случая раскрытия кольца циклобутена, и если это проделать, то обнаружим, что орбитали основных состояний двух реагентов и орбитали продуктов согласуются. Заметим, что, как следует из рис. 14.16, эта перегруппи ровка есть дисротаторный процесс, причем на всех стадиях реакции сохраняется плоскость симметрии. [26]
Энергия этого электроциклического превращения так мала, что при. Процесс протекает намного быстрее, чем электроциклизация ациклических трненов; это обусловлено тем, что кольцо удерживает вместе реагирующие концы, и это понижает неблагоприятную отрицательную энтропию активации. В отличие от раскрытия кольца в дьюаровском бензоле раскрытие бицикло [4,1.0] гептадие-на-2 4 является дисротаторным процессом и легко согласуется с геометрией кольца. Электропоакиепторные группы, такие как CN и CFSj сдвигают равновесие в сторону бицнкличеекай системы. Электроциклическая реакция протекает при температуре, близкой к комнатной; устанавливается равновесие, смещенное в сторону циклооктатриена. При несколько более высоких температурах образовавшаяся гексатриеновая система подвергается последующей дисротаторной циклизации и устанавливается равновесие с соответствующим бицйкло [4,2.0] октадиеиом. [27]
Любую электроциклическую реакцию можно осуществить как при нагревании ( термически), так и при облучении ( фотохимически), однако стереохимический результат в этих двух случаях будет различным. Синтетическая значимость электроциклических реакций существенно зависит от положения равновесия, поскольку это определяет, может ли циклический изомер быть выделен с удовлетворительным выходом из реакционной смеси. Положение этого равновесия может быть различным для термических и фотохимических процессов. Стереохимические различия между конротаторными и дисротаторными процессами исчезают в том случае, когда терминальное положение ациклической т-системы занимает гетероатом. Так, для большинства электроциклических процессов, приводящих к образованию гетероциклических соединений, правила Вудвар-да - Гофмана не имеют смысла. [28]
Страницы: 1 2