Прочность - образуемый комплекс
Cтраница 1
Прочность образуемых комплексов незначительна ( см. Приложение 1), поэтому соединение практически не применяется в качестве комплексообразующего реагента. [1]
Прочность образуемых комплексов изменяется в широких пределах и зависит от ряда факторов: строения и стереохимии комплексообразователя, числа, характера, основности или кислотности его комплексообразующих групп и атомов, положения в периодической системе связываемого металла, величины его ионного радиуса, валентности, координационного числа, а также от температуры и характера среды. [2]
Прочность образуемых комплексов незначительна ( см. Приложение 1), поэтому соединение практически не применяется в качестве комплексообразующего реагента. [3]
Характеристики прочности других образуемых комплексов ( водородных, гидроксокомплексов состава 1: 2, 2: 1 и др.) не включены в таблицу во избежание ее загромождения, и имеются в приведенной оригинальной литературе и частично в соответствующих главах книги. [4]
Другой путь достижения селективности и прочности образуемых комплексов связан с возможностью создания прочных полиядерных соединений типа смешанных хелатов. Как показали исследования, способ рационального построения смешанных хелатов с участием лигандов различной дентатности может быть эффективен при отмывке отложений сложного состава. [5]
При увеличении числа фосфоновых групп в молекуле комплек-сообразующего агента прочность образуемых комплексов сначала увеличивается, а затем уменьшается. Этот факт можно объяснить тем, что взаимное отталкивание фосфоновых групп, несущих двойной отрицательный заряд, возрастает с увеличением их количества. Кроме того, уже ЭДТФ - десяти-дентатный лиганд-полностью насыщает координационную емкость щелочноземельных элементов. [6]
Увеличение дентатности комплексона в результате введения дополнительных фосфоновых групп вызывает увеличение прочности образуемых комплексов. Так, этилендиаминтетраметилфосфоновая и диэтилентриаминпентаметилфосфоновая кислоты являются более сильными комплексообразующими агентами по отношению к редкоземельным элементам, чем карбоксилсодержащие аналоги. Устойчивость нормальных комплексов рассматриваемых комплексонов намного выше устойчивости соответствующих комплексов этиленди-аминтетрауксусной кислоты и не уступает устойчивости комплексов диэтилентриаминпентауксусной кислоты, считающейся оптимальным реагентом при комплексообразовании с редкоземельными элементами. Комплексы редкоземельных элементов с ЭДУФ по устойчивости также превышают комплексы с ЭДТА, исключение составляют лишь комплексы лютеция и иттербия. [7]
В литературе уже неоднократно были указания на существование соответствия между энергией ионизации металла и прочностью образуемого комплекса в тех случаях, когда связь имеет в основном ковалентныи характер. [8]
В литературе уже неоднократно были указания на существование соответствия между энергией ионизации металла и прочностью образуемого комплекса в тех случаях, когда связь имеет в основном ковалентный характер. [9]
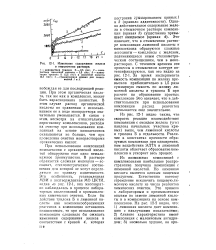 |
Изменение содержания железа в отмывочном растворе. [10] |
Из рис. 12 - 1 видно также, что скорость реакции взаимодействия композиции с оксидом железа ( угол наклона начальных участков кривых) выше, чем лимонной кислоты и трилона Б в отдельности. Различие в константах прочности образуемых комплексов при одновременном воздействии ЭДТА и лимонной кислоты облегчает образование ком-плексов и ускоряет весь процесс. [11]
Иная картина наблюдается в комплексонах на основе 2 2 -ди-фенилдиамина ( XIX-XXIII); имиподиацетатные группировки в этих соединениях сближены, что создает возможность координации металла с обеими хелатообразующими группами с замыканием максимального числа хелатных циклов, приходящихся на один катион металла. Это и приводит к увеличению прочности образуемых комплексов. К сожалению, количественная характеристика прочности комплексов отсутствует. [12]
Иная картина наблюдается в комплексонах на основе 2 2 -ди-фенилдиамина ( XIX-XXIII), иминодйацетатные группировки в этих соединениях сближены, что создает возможность координации металла с обеими хелатообразующими группами с замыканием максимального числа хелатных циклов, приходящихся на один катион металла. Это и приводит к увеличению прочности образуемых комплексов. К сожалению, количественная характеристика прочности комплексов отсутствует. [13]
Предварительные опыты, по разделению иттриевой группы редкоземельных элементов в присутствии комплексообразую-щих веществ на сульфосмолах с различным содержанием ДВЕ, показали, что при применении в качестве элюента раствора комплексообразующего вещества влияние структуры смолы сильно снижается. В этом случае главную роль безусловно играет прочность образуемых комплексов. [14]
Стабильность хелатов зависит от тех же характеристик лиганда и, кроме того, от природы атома лиганда ( донорного атома), через который осуществляется связь с центральным атомом, и степени его поляризуемости, увеличивающейся при наличии двойных связей в молекуле. Координационное число центрального атома, стереохимия и прочность образуемых комплексов определяются этими же характеристиками. [15]
Страницы: 1 2