Прочность - связь - металл
Cтраница 1
Прочность связи металла с белком зависит от функциональных групп, с которыми он связан. [1]
Прочность связи металлов с порфиринами необычайно велика. Широко известна весьма большая реакционная способность магнийорганических соединений; даже азотистые соединения Гриньяра легко разлагаются водой. В случае же хлорофилла магнийорганическоо соединение остается устойчивым не только к действию воды, но даже в течение ограниченного времени, к действию двуокиси углерода. [2]
Прочность связи металла и резины, склеенных при помощи тер-мопрена, должна быть не менее 5 кг / смг. [3]
Но если увеличение прочности связи металла и ТБФ в экстрагируемом сольвате способствует переходу вещества в органическую фазу, то конкурирующий процесс - гидратация - действует в прямо противоположном направлении, удерживая РЗ в водной фазе. Естественно, что при низкой концентрации нитрат-ионов в растворе, когда доминирует процесс гидратации, понижение коэффициентов распределения будет сильнее у более тяжелых элементов. [4]
Таким образом, на прочность связи металла с любым заместителем очень мало влияет природа соседних ( цис -) с этой связью атомов или молекул, в то время как атомы или молекулы, находящиеся в наиболее удаленной области комплексного соединений ( в транс-положении) на диагонали квадрата, сильно влияют на эту связь. Гринберг высказал предположение, что и в цис-положении должно существовать какое-то взаимодействие атомов. В начале 1950 - х годов появились первые экспериментальные данные, позволявшие предполагать наличие влияния цмс-расположенных лигандов. [5]
Поляризующее же влияние заместителей на прочность связи металла с кислотным остатком в его солях выяснено еще в недостаточной мере. Оно не всегда имеет одинаковый характер в сравнении с изменением прочности связи водорода, замещающегося металлом. Установление этой зависимости в случае введения в молекулу электроноакцептор-ных заместителей затрудняется элиминированием поляризующего влияния эффектом утяжеления. [6]
 |
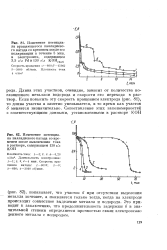
Валентные колебания карбонильных групп в молекулах типа ХМ ( СО5 ( симметрия Gtv, разрешенные в ИК-спектрах. [7] |
Таким образом, при отсутствии сильного оттягивания - электронов металла заместителем X прочность связи металла с аксиальной СО-группой должна быть выше, чем с каждой из четырех экваториальных групп. [8]
Это приводит к заключению, что продолжительность задержки б в значительной степени определяется прочностью связи электроосаж-денного металла с водородом. [10]
Спектры поглощения были сняты на спектрофотометре СФ-4 в кюветах толщиной 1 см. Наблюдаемое смещение закономерно объяснить увеличением прочности связи металла с фталоцианиновым кольцом ( ростом стабильности комплексов) в этом ряду. [11]
Как и следует из общих положений метода молекулярных орбиталей, а изучение природы химической связи в этих соединениях подтвердило такой вывод, прочность связи металла с органическим лигандом тем выше, чем сильнее перекрываются орбитали металла и лиганда, чем ближе энергии этих орбиталей, чем большее число связывающих и меньшее число разрыхляющих молекулярных орбиталей занято электронами. При детальном рассмотрении электронного строения отдельных комплексов показано, что при образовании тг-связи алкена с металлом происходит не только передача тг-электронов на вакантную орбиталь металла. Дополнительно осуществляется перенос электронов с других орбита-лей металла на разрыхляющие орбитали лиганда тг-симметрии. Это объясняет низкую полярность связи металл-лиганд в таких комплексных соединениях и повышает их кинетическую стабильность. [12]
Предложенная Полингом теория резонирующих связей в металлах позволила принципиально новым путем подойти к выяснению характера связи адсорбированных газов и того важного значения, которое имеют rf - уровни для прочности связей металла с субстратом. [13]
Кривая 4, соответствующая титрованию кислоты в присутствии эквимолярной концентрации никеля, показывает образование комплекса, у которого бетаиновые протоны еще не связаны с азотом и, следовательно, устойчивость комплекса определяется прочностью связи металла с кислородными атомами фосфиновых групп. [14]
В противоположность алюминию Ga, In и Т1 помимо трехвалентных образуют двух - и одновалентные малоустойчивые окислы, например ТЬО и GaO. Прочность связи металла с кислородом уменьшается в ряду Ga2O3 - In2O3 - T12O3; Ga2O3 плавится при 1740 С без разложения, 1п2О3 - при 850 С изменяет состав до 1п3О4, а Т12О3 начинает терять кислород уже при 90 С. Взаимодействие окислов урана с окислами Ga, In и Т1 почти не изучено. Окислы Sc2O3 и Y2O3 имеют кубическую объемноцентриро-ванную решетку типа Мп2О3, структура которой тесно связана со структурой флюорита. [15]
Страницы: 1 2 3