Пурбе
Cтраница 3
Следует, отметить, что диаграммы Пурбе имеют большое значение, независимо от использования их для определения условий пассивации. [31]
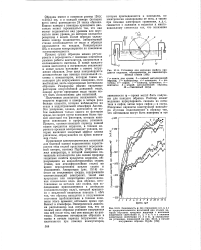
На рис. 11 6 представлена диаграмма Пурбе для железа. Она имеет две области коррозии; в первой из них стабильны ионы двух - и трехвалентного железа, а во второй - феррат-ион. На рис. 12 даны схемы диаграмм Пурбе для некоторых технически важных металлов. [32]
Основы построения диаграмм изложены в 1946 г. Пурбе. [33]
Рассмотрим это на примере [5] упрощенной диаграммы Пурбе для систем Fe - H2O ( рис. 3.7), чаще всего используемой при электрокоагуляции загрязненных жидкостей. На этой диаграмме учитываются лишь гидратированные формы оксидов и наиболее важные в коррозионном аспекте реакции в рассматриваемой системе. На ней представлены далеко не все варианты образования возможных продуктов взаимодействия железа с водой. [34]
Более полная характеристика термодинамической устойчивости металлов дана в диаграммах Пурбе ( см. гл. [35]
При выборе активного электрода для электрогенерации титранта исходят из диаграммы Пурбе, которая определяет возможность электропревращения металла при различных значениях рН раствора и показывает перенапряжение водорода. С учетом данных, полученных из диаграммы Пурбе, снимают кривые ток - потенциал и по данным кулонометрического титрования стандартных количеств определяемого вещества находят оптимальные условия электрорастворения металлического электрода. [36]
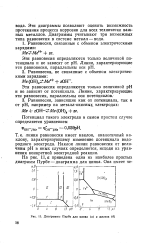 |
Диаграммы Пурбе для цинка ( а а железа ( б. [37] |
На рис. И, а приведена одна из наиболее простых диаграмм Пурбе - диаграмма для цинка. [38]
Термодинамическая устойчивость металлов в водных растворах может быть определена с помощью диаграмм Пурбе, составленных почти для всех металлов. Практически многие из них в водных растворах более устойчивы, чем это следует из диаграмм Пурбе, вследствие наличия на их поверхности оксидных пленок и перенапряжения при выделении водорода. [39]
Учитывая взаимосвязь Eh и рН, в практике геохимических исследований получили распространение диаграммы Пурбе, описывающие потенциал водной среды, который определяется главным образом окислением-восстановлением в системе железо-сера ( рис. 1), изменениями в равновесии угольная кислота-гидрокарбонат и гидролизом сульфатов железа. В этих изменениях значительная роль отводится геохимическим реакциям, например первая стадия окисления пирита, а также биогенным процессам. Соотношения, приведенные на диаграмме ( см. рис, 1), не зависят от общего содержания железа в подземной воде и характеризуют только те условия, в которых соотношение железосодержащих компонентов равно единице. Рассматривая насыщенность подземных вод каким-либо соединением, следует исходить из предположения, что активность иона в пределах поля его преобладания будет равна суммарной активности растворенной серы. [40]
Применение электрохимических испытаний для быстрой оценки коррозионных характеристик этих сталей представляет определенный интерес, поэтому Пурбе [150] предложил аппаратуру, в которой измерения потенциала используются для оценки природы защитных свойств продуктов коррозии, образующихся на низколегированных сталях ( таких, как атмосферостойкие стали) во время периодических циклов сушки и увлажнения. Аппаратура ( рис. 10.14) состоит из стеклянного сосуда, содержащего соответствующий электролит, такой как природная или искусственно приготовленная специальная вода. Два образца, изготовленные из металла или сплава, при исследовании присоединяются к шпинделю ( соединительному валу), который вращается с медленной скоростью порядка 1 об / ч так, что образец находится в погруженном состоянии приблизительно в течение половины этого времени; остальное время пребывает в атмосфере. Электрическая лампочка расположена над сосудом так, что за полный цикл образцы успевают высушиться под ней после того, как они выходят из раствора. [42]
Для характеристики термодинамической устойчивости электрохимических систем в водных средах пользуются диаграммами ф-р Н, называемыми диаграммами Пурбе. Линия аЬ на рисунке выражает зависимость потенциала водородного, а линия cd - кислородного электрода от рН среды. [43]
Следует отметить, что по величине изобарно-изотермического потенциала и по потенциалу металла Е нельзя определить скорость коррозии металла, используя диаграмму Пурбе. [44]
Оценку вероятного поведения каждого металла в условиях, близких к равновесным, можно получить, используя диаграммы потенциал - рН ( диаграммы Пурбе, рассмотренные в гл. [45]
Страницы: 1 2 3 4