Путь - протекание - реакция
Cтраница 1
Путь протекания реакции может быть изменен введением в систему катализаторов. [1]
Среди этих путей протекания реакции наиболее доступен для понимания основно каталитический из-за его симметрии и относительно небольшого числа возможных механизмов катализа переноса протона. [2]
Соотношение указанных двух путей протекания реакции зависит от глубины превращения кислоты. [3]
Соотношение указанных двух путей протекания реакции зависит от глубины превращения кислоты. Таким образом, процесс гидрогенизации до спиртов протекает без деструкции С - С-связей. [4]
В настоящее время априорное предсказание пути протекания реакции невозможно. Только знание энергий всех возможных промежуточных соединений позволит предсказать путь реакции и соответствующее ему выражение скорости. Поскольку получить такую информацию заранее нельзя, то предсказать вид зависимости скорости реакций от концентрации реагирующих веществ не представляется возможным. На практике форма экспериментального выражения скорости часто служит ключом при исследовании энергий промежуточных соединений реакции. [5]
В связи с упомянутым отметим, что свободнорадикальный путь протекания реакций является скорее исключением, чем правилом. Он также наименее выгоден и энергетически, поскольку при полном разрыве химических связей возникают ак-тивационные барьеры порядка их прочности. Энергии же активации хотя и понижаются, что особенно заметно при квадратичном обрыве цепей, но все еще остаются достаточно высокими. [6]
Развитие стереохимии неразрывно связано с изучением ме-ханизма реакций, так как целью таких исследований является детальное выяснение пути протекания реакции и, следовательно, определение геометрии промежуточных состояний, через которые проходит реагирующая система в процессе превращения исходных веществ в конечные продукты. В последнее время в этой области достигнуты большие успехи; в настоящей главе рассматриваются только отдельные вопросы, причем изложение их не является исчерпывающим. [7]
Если известны константы скорости всех реакций и константы равновесий, входящих в рассматриваемую квадратную диаграмму, например, в диаграмму окисления АН2 до А ( см. схему 2.52), то в принципе можно было бы установить путь протекания реакции и рассчитать форму / - кривой. Однако обычно многих из этих данных нет. [8]
В последнем случае происходит образование боразил-аммониевой соли, а не внутримолекулярное выделение хлористого водорода. Путь протекания реакции определяется факторами стабильности, которые в свою очередь зависят главным образом от стерических факторов. [9]
Характер спектров не зависит от строения исходных литиевых солей 5-нитро - З - трет. На анион-радикальный путь протекания реакции нуклеофильного ароматического замещения указывает также образование бициклических 1 3-тетрагидрооксазинов, наличие которых, по-видимому, связано с возникновением в ходе реакции и последующей рекомбинацией 5-нитро - 3-алкил - 1 3-тетрагидрооксазин - 5-ильных радикалов. Кроме того, в отдельных опытах установлено ингибирующее действие кислорода. [10]
Наклон катодной кривой также соответствует любому из этих трех путей и лимитирующих стадий реакции. Вычисленная зависимость от рН одинакова для всех трех путей протекания реакции и не может помочь однозначному выбору среди них. Анализ результатов по влиянию рН дает возможность предположить, что разряжающейся частицей является молекула воды. На основе зависимости плотности тока от парциального давления кислорода также невозможно сделать однозначный выбор среди предполагаемых путей реакции. [11]
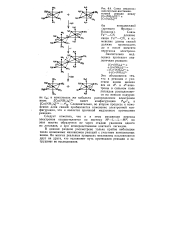 |
Схема механизма окислительно-восстановительной реакции между [ Со ( МН3 5С1 ] 2 и [ Сг ( Н20 6р. [12] |
В данном разделе рассмотрено только крайне небольшое число возможных механизмов реакций с участием комплексных ионов. Во многих реальных процессах механизмы наслаиваются друг на друга, что осложняет путь протекания реакции и затрудняет ее исследование. [13]
А / см2) перенапряжение кислорода при выделении из щелочных растворов растет в следующем ряду металлов: Fe, Ni, Cd, Pb, Au, Pt. Таким образом, подводя итог обсуждаемых данных, можно констатировать многообразие форм и путей протекания реакции электрохимического выделения кислорода, сложные зависимости от многих факторов, что очень затрудняет выявление кинетических закономерностей процесса. [14]
Книга посвящена наиболее распространенным в мире Элементам - органогенам: водороду, кислороду, углероду и азоту. На этом конкретном материале рассматриваются исходные положения учения о строении атома, системе элементов, химической связи и строении молекул, путях протекания реакций. Подробно рассматриваются статистико-термодинамические представления о химическом равновесии. [15]
Страницы: 1 2