Радиус - анион
Cтраница 1
Радиусы анионов возрастают от F к J, и соответственно уменьшается сила взаимодействия ( стяжения) анионов расплавленной соли с катионами металлической фазы, способствующая ослаблению связи ионов металла с соседними и, следовательно, увеличению вероятности перехода их в расплавленную соль. Поэтому переход ионов металла в расплавленную соль с большей легкостью будет происходить в случае - расплавленных фторидов и хлоридов и с меньшей - в случае расплавленных бромидов и иодидов. В соответствии с этим электродные потенциалы металлов должны быть более отрицательны в расплавленных фторидах и хлоридах, чем в расплавленных бромидах и иодидах. Здесь, однако, как мы увидим ниже, имеются отклонения, обусловливаемые поляризацией ионов. [1]
Радиусы анионов галогенов вычислены авторами в предположении, что они находятся в контакте с ионами лития. Первая полная таблица была составлена Гольдш-мидтом [125] ( также [3], стр. [2]
Эти радиусы анионов часто, используют для расчета по уравнению Борна свободной энергии и энтропии гидратации ионов. Однако даже в случае простых анионов, для того чтобы расчетные данные совпадали с экспериментальными, необходима эмпирическая поправка. [3]
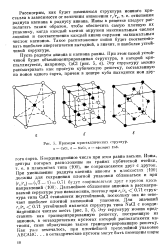 |
Примеры кристаллических структур, а - CsCl, 6 - NaCI, в - сфалерит ZnS. [4] |
Пусть радиусы аниона и катиона равны. [5]
Дан - радиус аниона, ориентировочно принятый равным - 5 А. Очевидно, что Е & н - энергия активации взаимодиффузии центрального иона относительно замороженной поляризации. [6]
При разности радиусов анионов Вг - и СГ, равной 0 15 A, J и Вг -, равной 0 24 А, различие в соответственных тепловых эффектах должно составить 2000 - 4000 кал / моль. [7]
С повышением температуры радиус аниона увеличивается быстрее, чем радиус катиона, вследствие чего происходит увеличение разности размеров ионных радиусов. Поэтому некоторые кристаллы ( например, хлористый цезий и хлористый рубидий) при повышении температуры изменяют свою кристаллическую структуру: из объемноцентрированного куба перестраиваются в элементарный куб. [8]
На ординате рис. 52 отложены радиусы анионов, по абсциссе-радиусы катионов. Линии соответствуют величинам vRT lnaLpacT TvASL. Области, лежащей ниже кривой 4 ( vRT na 4 ккал / г-ион), соответствует хорошая растворимость, области, заключенной между кривыми 2 и 3, соответствует значительная растворимость, области между кривыми 1 и 2 соответствует малая растворимость и областям 1 - 0 и - 1 - 0 соответствует плохая растворимость. Диаграмма относится к растворимости в воде. [9]
В гомологических рядах соединений отношение радиуса аниона к радиусу катиона возрастает в ряду с повышением атомного номера. При некотором критическом значении этого отношения может измениться тип структуры. [10]
Поскольку межмолекулярные радиусы практически равны радиусам анионов, при вычислениях воспользуемся данными табл. IV приложения. [11]
Поскольку межмолекулярные радиусы практически равны радиусам анионов, при вычислениях воспользуемся данными табл. IV приложения. [12]
Так как радиус катиона обычно меньше радиуса аниона, то, например, для соединений типа АВ упаковка с координационным числом 12 в ионных решетках не достигается. Приведенные здесь координационные числа приближенные. Надо учитывать, что поляризация ионов, их поляризующее действие и другие свойства могут существенно влиять на характер связи между ними, поэтому есть много отступлений от указанных чисел. Уже в кристаллах типа сфалерита ( или вюрцита) связь иошю-ко-валептная. Координационное число 3 в ионных кристаллах вообще не реализуется. [13]
В этом случае ассоциация уменьшается сростом радиуса аниона, что часто наблюдается на практике. В отличие от галоидных солей, LiCldi в этом растворителе полностью диссоциирован. [14]
Так как в кристаллах с ионной связью радиусы анионов, как правило, значительно больше радиусов катионов, то еу - будет больше EV - Это обстоятельство наряду с пространственными трудностями, связанными с внедрением аниона в междоузлие, препятствует образованию дефектов по Френкелю в анионной подрешетке, за исключением некоторых особых случаев. Вообще говоря, в структурах с более плотноупакованной решеткой предпочтительнее дефекты по Шоттки, поскольку энергия, необходимая для перемещения иона М в междоузлии, будет больше энергии образования анионной вакансии. [15]
Страницы: 1 2 3 4