Радиус - атом - водород
Cтраница 4
Монозамещенные поли-а-олефины, у которых замещающие атомы или группы атомов беспорядочно расположены по цепи, но их ван-дер-ваальсовы радиусы близки к радиусу атома водорода. Так, поли-винилфторид [ - СН2 - CHF - ] кристаллизуется ( ван-дер-ваальсов радиус атома водорода 1 1 А, атома фтора 1 35 А), в то время как поливи-нилхлорид [ - СН2 - СНС1 - ] п ( радиус атома хлора 1 7 А) уже не кристаллизуется. Не кристаллизуются атактический полистирол, поливинил-ацетат, но поливиниловый спирт, полученный омылением поливинил-ацетата, кристаллизуется, так как гидроксильная группа меньше эфирной группы. [46]
Поэтому, например, в графите расстояние между атомами углерода равно 1 45 А т.е. оно меньше на 0 09 А, чем в алмазе. В одном из сообщений Хаггинса, относящемся к тому же времени [54], приводится значение радиуса атома водорода 0.73 А - величина совершенно неправдоподобная, как мы хорошо знаем теперь. [47]
Позднее было установлено, что, помимо напряжения, возникающего в связи с деформацией валентных углов атомов углерода ( углового напряжения), в циклах могут возникать напряжения за счет взаимного отталкивания нейтральных атомов, например атомов водорода. Если центры атомов водорода, связанных с разными углеродными атомами, расположены на расстоянии, близком к сумме ван-дер-ваальсо-вых радиусов атомов водорода, возникает так называемое торсионное напряжение. Такое напряжение может возникать даже в соединениях с открытыми цепями. Если допустить совершенно свободное вращение атомов вокруг простых связей, то легко представить себе, что при различном взаимном расположении групп и атомов в процессе этого вращения молекула будет характеризоваться различным уровнем энергии. Так, в молекуле этана наименее энергетически выгодным положением метальных групп является такое, когда атомы водорода одной метильной группы расположены напротив атомов водорода другой метильной группы. [48]
Если центры атомов водорода, связанных с разными углеродными атомами, расположены на расстоянии, близком к сумме зан-дер-ваальсовых радиусов атомов водорода, возникает так называемое торсионное напряжение. Такое напряжение может возникать даже в соединениях с открытыми цепями. Так, в моле куле этана наименее энергетически выгодным положением могильных групп является такое, когда атомы водорода одно): метильной группы расположены напротив атомов водорода другой метильной группы. [49]
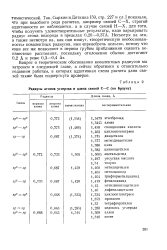 |
Радиусы атомов углерода и длина связей С-С ( по Брауну. [50] |
С-X, строгой аддитивности не наблюдается, а в случае связей Н-X, для того, чтобы получить удовлетворительные результаты, надо варьировать радиус атома водорода в пределах 0 20 - 0.37 А. [51]
Следует обратить внимание на то, что в атомах различных элементов главное квантовое число по-разному определяет размеры орбиталей. Например, при п2 размер 25-орбитали атома лития характеризуется радиусом атома 1 6 А, а радиус атома бериллия, соответствующий также размеру 25-орбитали, составляет всего 1 1 А. Радиусы атомов водорода ( 0 53 А), лития ( 1 6 А), натрия ( 1 8 А), которые все являются s - элементами, не относятся друг к другу как квадраты главных квантовых чисел ( см. стр. Все эти кажущиеся несоответствия объясняются тем, что размеры орбиталей квантовых уровней пропорциональны в первом приближении п2 только для одного значения заряда ядра атома. [52]
А и октаэдрические с радиусом 0 594 - 0 62 А. Макквиллэн [277-279] полагает, что атомы водорода в ос - и р-титане располагаются в ок-таэдрических порах. Поскольку радиус атомов водорода значительно меньше размера октаэдрических пустот, то при внедрении в них водорода параллельно с уменьшением свободной энергии системы благодаря химическому взаимодействию происходит ее повышение, обусловленное большой свободой колебаний атомов водорода в таких пустотах. По этой причине растворимость водорода в а-фазе мала. Уже при сравнительно низких концентрациях твердые растворы водорода в а-титане становятся термодинамически неустойчивыми. [53]
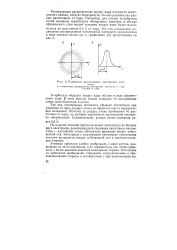 |
Радиальное распределение электронной плотности. [54] |
Так как электронная плотность убывает постепенно при удалении от ядра, радиус атома не является строго определенной величиной. Поэтому за радиус атома принимают то рас-1 стояние от ядра, на котором вероятность нахождения электрона максимальна. Следовательно, радиус атома водорода равен 0 5 А. [55]
 |
Схема строения что размеры протона и электрона во много раз меньше атома. [56] |
Приведем некоторые данные из области атомной структуры. В атоме водорода радиус орбиты, по которой движется электрон вокруг ядра, равен 0 53 - 10 - 8 см0 53 А. Этой же величине равен и радиус атома водорода. [57]
Стереорегулярность, или тактичность, является необходимым, хотя и не всегда достаточным условием кристаллизуе-мости полимера. Исключением из этого правила является поливиниловый спирт ( СН2 - СНОН), который может быть атак-тическим и все же кристаллизоваться. Это объясняется тем, что вандерваальсовы радиусы атома водорода и ОН-группы близки, и они взаимозаменяемы в кристаллической решетке. [58]
 |
Высоты энергетических барьеров внутреннего вращения. [59] |
Грубую оценку можно получить, считая, что в этане из-за малого ван-дер-ваальсова радиуса атома водорода U ( p) целиком определяется эффектом ориентации и что у производных этана этот эффект тот же. [60]
Страницы: 1 2 3 4