Радиус - атом - элемент
Cтраница 1
Радиусы атомов элементов этой подгруппы меньше радиусов атомов подгруппы титана и мало изменяются от ванадия к танталу. Как следствие этого - восстановительные свойства элементов ниже, чем в подгруппе титана; связь с электроотрицательными элементами ( О, С1) близка к ковалентной. [1]
Радиусы атомов элементов находятся путем деления пополам расстояния между ядрами двух смежных атомов в кристаллической решетке простого вещества. [2]
Радиусы атомов элементов увеличиваются от кислорода к полонию, поэтому окислительные свойства ослабевают и усиливаются восстановительные. Элементы этой подгруппы образуют водородные соединения H2R - халькогеноводороды. [3]
Радиусы атомов элементов находятся путем деления пополам расстояния между ядрами двух смежных атомов в кристаллической решет ке простого вещества. [4]
Радиусы атомов элементов подгруппы незначительно отличаются от величин у предшествующих элементов периодической системы. Радиусы же ионов меньше, чем у щелочных металлов тех же периодов и нарастают по подгруппе сверху вниз. Си к Аи и нарастает с увеличением заряда катиона. Заряды ядер значительно выше, чем у щелочных металлов тех же периодов. Отсюда вытекают особенности свойств соединений этих элементов. Основные свойства гидроксидов у них выражены слабее, возрастают от Си к Ag и уменьшаются по мере увеличения заряда катиона. [5]
Радиусы атомов элементов IVA-группы закономерно растут с увеличением порядковых номеров ( табл. 24), ионизационные потенциалы и общая электроотрицательность уменьшаются. Тем не менее углерод и кремний существенно отличаются по свойствам от остальных элементов группы. У германия уже имеются металлические признаки, а у олова и свинца они преобладают над неметаллическими. Кроме того, углерод и кремний отличаются от других элементов IVA-группы многочисленностью и многообразием химических соединений. Углерод в большинстве кислородных соединений ( за редкими исключениями) проявляет степень окисления 4, соединения кремния со степенью окисления 4 также достаточно устойчивы. Но от германия к свинцу прочность соединений, в которых они проявляют степень окисления 4, уменьшается. [6]
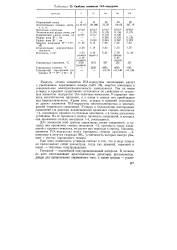 |
Свойства элементов IVA-подгруппы. [7] |
Радиусы атомов элементов IVA-подгруппы закономерно растут с увеличением порядкового номера ( табл. 25), энергия ионизации и относительная электроотрицательность уменьшаются. Тем не менее углерод и кремний существенно отличаются по свойствам от остальных элементов подгруппы. У германия имеются металлические признаки, а у олова и свинца они преобладают над неметаллическими. Кроме того, углерод и кремний отличаются от других элементов IVA-подгруппы многочисленностью и многообразием химических соединений. Углерод в большинстве кислородных соединений ( за редкими исключениями) проявляет степень окисления 4, соединения кремния со степенью окисления 4 также достаточно устойчивы. Но от германия к свинцу прочность соединений, в которых они проявляют степень окисления 4, уменьшается. [8]
Радиусы атомов элементов подгруппы хрома меньше, чем у предшествующих им членов в подгруппе ванадия, и мало меняются сверху вниз. Поэтому элементы не образуют стехиометрических водородных соединений, но растворяют водород в значительных количествах. Устойчивость соединений высшей положительной степени окисления растет от хрома к вольфраму, а их окислительные свойства падают. [9]
Радиусы атомов элементов подгруппы меди значительно меньше радиусов атомов щелочных металлов, что обусловлено наличием восемнадцати электронов на их предпоследнем слое. Поэтому для меди и ее аналогов характерны значительно большие значения ионизационного потенциала и сродства к электрону, чем для щелочных металлов. Это обстоятельство является важнейшей причиной различия в свойствах элементов подгруппы меди и щелочных металлов. [10]
Как изменяются радиусы атомов элементов в периодах и группах. [11]
Как изменяются радиусы атомов лантаноидных элементов с возрастанием атомного номера. Какое влияние это изменение оказывает на отличие некоторых свойств d - элементов 4 периода от свойств d - элементов 5 и 6 периодов, находящихся в одинаковых подгруппах. [12]
С увеличением радиуса атома элемента возрастает экранизирующее действие электронов глубинных уровней на валентные электроны, в связи с чем уменьшается прочность связи последних с ядром. [13]
Это видно из сопоставления радиусов атомов элементов главной и побочной подгрупп, находящихся в тех же периодах. [14]
Вообще говоря, с увеличением атомного веса радиусы атомов элементов данного периода таблицы Менделеева уменьшаются. В шестом периоде у редкоземельных элементов, вследствие того что электроны заполняют 4 / г-уровень, наблюдается лантаноидное сжатие. [15]
Страницы: 1 2 3