Ионный радиус - элемент
Cтраница 1
Обычно ионные радиусы элементов периодически изменяются с изменением атомного номера ( см. рис. 8, стр. [1]
Достаточно сравнить ионные радиусы элементов любого ряда Вернадского, чтобы убедиться в справедливости этого положения. [2]
Рассмотрение системы ионных радиусов элементов позволяет сделать следующие общие выводы. [3]
Заметно различаются и ионные радиусы элементов этой подгруппы. [4]
С возрастанием валентности и уменьшением ионного радиуса элемента основные свойства его гидрата окисла должны ослабляться, а кислотные усиливаться. [5]
Выбор для определения условных размеров молекул ионных радиусов элементов при координационном числе 6 [26] связан с тем, что это число представляется наиболее распространенным и может быть принято за среднее для большинства ионов в соединениях. Конечно, нельзя считать, что для всех кристаллических структур характерны эта координация и соответствующие ионные радиусы составляющих элементов. Характерным примером являются результаты исследований в системах В. [6]
Комплексообразующая способность РЗЭ возрастает с уменьшением ионного радиуса элемента в ряду La - Lu. У всех РЗЭ в трехвалентном состоянии координационное число равно шести. Комплексные соединения образуют также церий и празеодим, будучи в четырехвалентном состоянии, европий и самарий - в двухвалентном состоянии. Для комплексных соединений РЗЭ с органическими аддендами характерна связь через атом кислорода карбоксильной, карбонильной и гидроксильной групп. [7]
Для таких структур важное значение имеют величины ионных радиусов элементов, определяющие геометрические пределы устойчивости структур с различными координационными числами. [8]
Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса элемента у гидроксидов преобладает кислотный тип диссоциации. [9]
Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса элемента у гидро-ксидов преобладает кислотный тип диссоциации. [10]
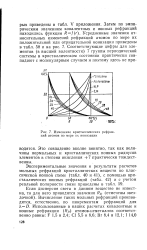 |
Изменение кристаллических рефракций атомов по мере их ионизации. [11] |
Это совпадение вполне понятно, так как величины нормальных и кристаллических ионных радиусов элементов в степени окисления 7 практически тождественны. [12]
В качестве руководства при подборе носителей для соосаждения по методу образования смешанных кристаллов на рис. 3 и в табл. 7 представлены ионные радиусы элементов. Соотношения валентностей имеют меньшее значение. Различие в зарядах может быть скомпенсировано созамещениями или вакансиями решетки. [13]
Достаточно сравнить ионные радиусы элементов любого ряда Вернадского, чтобы убедиться в справедливости этого положения. [14]
Различие в диффузионных скоростях доноров и акцепторов в кремнии связано с соотношением ионных радиусов атомов кремния и элементов III и V групп. Большее отличие ионных радиусов элементов III группы по сравнению с элементами V группы от радиусов атомов кремния обусловливает большие скорости диффузии акцепторов. [15]
Страницы: 1 2