Металлический радиус
Cтраница 1
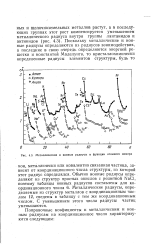 |
Металлические и ионные радиусы в функции атомного номера. [1] |
Металлические радиусы, определяемые из структур металлов с координационным числом 12, сведены в таблицу с тем же координационным числом. С уменьшением этого числа радиусы частиц уменьшаются. [2]
Металлические радиусы даны для координационного числа 12, при значительной поляризации - для истинного координационного числа той структуры, из которой определялись радиусы. Подобные радиусы приведены в прямых скоб -, ках. [3]
Металлические радиусы для каждого из трех рядов элементов переходных групп имеют, как мы видели, минимумы между шестым и десятым атомами ряда. [4]
 |
Система кристаллохимических радиусов атомов и ионов. [5] |
Металлические радиусы отвечают КЧ12; ковалентные радиусы КЧ-4 и одинарной связи. Для Sb и Sn кроме ковалентных приведены также и металлические радиусы. Для других значений КЧ необходимо вводить поправку: - 6 % для КЧ4; 3 % для КЧ8; 12 % для КЧ. [6]
Металлический радиус также равен половине расстояния между центрами двух соседних атомов в кристаллической решетке металла. [7]
 |
Кристаллическая решетка иода.| Схематическое изображение металлической решетки. [8] |
Металлический радиус атома равен полусумме межъядерного расстояния d двух одинаковых частиц в металлическом кристалле. В молекуле же Na2 ( связь ковалентная) 20 308 нм, и ковале нтны и радиус атома Na0 308 / 20 154 нм. [9]
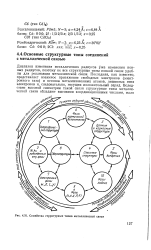 |
Семейства структурных типов металлической связи. [10] |
Диапазон изменения металлических радиусов уже изменения ионных радиусов, поэтому не все структурные типы ионной связи удобны для реализации металлической связи. Последняя, как известно, представляет взаимное притяжение свободных электронов ( электронного газа) и остовов металлизованных атомов, лишенных этих электронов и, следовательно, несущих положительный заряд. [11]
На системы металлических радиусов для элементов главной группы накладывается система ковалентных радиусов для бора, алюминия, галлия и индия. Обе кривые обнаруживают характерные зигзагообразные изломы. [12]
Вслед за металлическими радиусами целесообразно рассмотреть кова-лентные радиусы элементов, поскольку природа металлической и кова-лентной связи, по существу, одинакова-это коллективизация валентных электронов. По этой причине металлическую связь иногда называют кова-лентной ненаправленной связью. [13]
В самом деле, металлические радиусы элементов закономерно уменьшаются слева направо в Периодической системе вследствие роста Z в этом же направлении ( см. табл. 6) при одновременной ионизации внешних валентных электронов. В случае кристаллических соединений элементов а-подгрупп и 1в - 4в - подгрупп ситуация с изменением ковалентных радиусов, по существу, аналогична, но, начиная с элементов 5в - подгруппы, характер межатомных связей изменяется. Пока абсолютный радиус атома мал, действие Z превалирует над стерическим эффектом изолированных пар, но с увеличением номера периода оно начинает падать и к VI периоду оба эффекта полностью компенсируют друг друга. [14]
Весьма интересно, что металлические радиусы элементов переходных групп и других металлов очень близки к ковалентным радиусам этих атомов, как видно из сопоставления значений табл. 64 с соответствующими значениями октаэдрических ковалентных радиусов. [15]
Страницы: 1 2 3 4