Величина - параметр - расщепление
Cтраница 2
Интенсивность взаимодействия a -, я - и яразр-орбиталей лиганда с d - орбиталями центрального атома определяет величину параметра расщепления Д ( см. стр. Как указывалось, чем прочнее а - связь L - М, тем выше уровень aJJa3p - MO, а следовательно, выше значение Д ( см. стр. Аналогичным образом при сильном я - взаимодействии L - - М повышается уровень it ( d) - MO, т.е. вели чина Д уменьшается. [16]
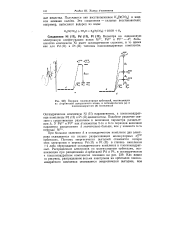 |
Порядок молекулярных орбиталей, возникающих. [17] |
Октаэдрические комплексы Ni ( II) парамагнитны, а плоскоквадратные комплексы Pd ( II) и Pt ( II) диамагнитны. Подобное различие связано с существенным различием в величинах параметра расщепления А. [18]
Из формулы видно, что сила кристаллического поля, измеряемая величиной QDq ( называемая параметром расщепления), зависит от свойств адденда и центрального атома, причем для двухвалентных ионов величина параметра расщепления меньше, чем для трехвалентных. Обычно, А лежит в пределах 1 - 4 эв. [19]
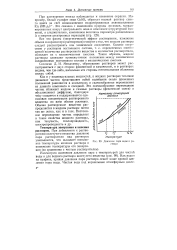 |
Давление пара воды и раствора. [20] |
При растворении иногда наблюдается и изменение окраски. Например, белый сульфат меди CuSO4 образует водный раствор синего цвета за счет возникновения гидратированных аквокомплексов [ Си ( ОН2) б ] 2 - Это связано с изменением природы лигандов, координированных вокруг центрального иона в комплексе ( структурной единице), а следовательно, изменением величины параметра расщепления А и энергии электронных переходов ( стр. [21]
Несмотря на одинаковую электронную конфигурацию ионов Ni2, Pd2 и Pt2 - d8, большинство комплексов Ni имеет октаэдрическое строение, в то время как для Pd ( II) и Pt ( II) типичны плоско-квадратные комплексы. Октаэдр ические комплексы Ni ( II) парамагнитны, а плоскоквадратные комплексы Pd ( II) и Pt ( II) - диамагнитны. Подобное различие связано с существенным различием в величинах параметра расщепления А. [22]
Страницы: 1 2