Величина - кинетический параметр
Cтраница 1
Величины кинетических параметров, полученные этим методом при пиролизе тефлона в вакууме, хорошо совпадают с литературными данными. [1]
Для испытываемой кинетической модели на основе априорной информации о процессе задаются р величин кинетических параметров. [2]
Для кинетической модели задаются, исходя из предварительной информации о процессе, р величин кинетических параметров. [3]
Для кинетической модели, исходя из предварительной информации о процессе, задаются р величинами кинетических параметров. [4]
В работе [5] показано, что при использовании субстратов со средней степенью полимеризации 20 и выше и когда степени полимеризации их подчиняются распределению Пуассона, величины кинетических параметров их неотличимы от параметров для деструкции гомополимеров с определенной степенью полимеризации. [5]
 |
Схема экзогенной индукции. [6] |
Картина регуляции осложняется тем, что у многих организмов для одного и того же субстрата часто используется несколько транспортных систем, отличающихся по специфичности и величине кинетических параметров. Существуют системы с узкой специфичностью, предназначенные только для одного или небольшого числа сходных субстратов, а также системы с широкой специфичностью. [7]
Ясно, что здесь нужен количественный анализ происхождения продуктов, приведенных в табл. 29; могли ли они образоваться в результате вторичной атаки а-амилазы на более длинные фрагменты субстрата ( для этого необходимы величины кинетических параметров действия фермента на олигосахариды с различной степенью полимеризации, см. табл. 3, 6, 8) или только последовательной репетивной ( множественной) атаки. К сожалению, подобный анализ не был проведен авторами работы [14], и причины наблюдаемых ими кинетических эффектов ( преимущественное образование мальтозы при гидролизе амилозы) остаются невыясненными. [8]
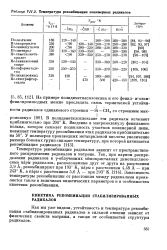 |
Температура рекомбинации полимерных радикалов. [9] |
Температура рекомбинации радикалов зависит от пространственного распределения радикалов в матрице. Зависимость температуры рекомбинации от расстояния между радикалами проявляется также в величинах кинетических параметров и в особенностях кинетики рекомбинации. [10]
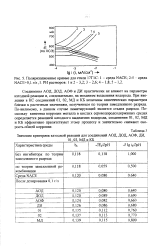 |
Поляризационные кривые для стали 17Г1С. 1 - среда NACE. 2 - 5 - среда NACE 0L г / л 1. РН растворов. 1 и 2 - 3 2. 3 - 2 6. 4 - 1 8. 5 - 1 2. [11] |
Соединения АОД, ДОД, АОФ и ДИ практически не влияют на параметры катодной реакции и, следовательно, на механизм выделения водорода. При введении в КС соединений 01, 02, МД и КБ величины кинетических параметров близки к расчетным значениям, полученным по теории замедленного разряда. По-видимому, в данном случае лимитирующей является стадия разряда. Поскольку кинетика коррозии металла в кислых сероводородсодержащих средах определяется. МД и КБ эффективно препятствуют этому процессу и значительно снижают скорость общей коррозии. [12]
Картирование активного центра деполимераз, основные подходы к которому были разработаны в начале 70 - х годов, явилось мощным стимулом к изучению строения и механизмов действия карбогид-раз. Картирование, как показано в настоящей главе, в принципе позволяет проводить сравнительное изучение сходных ферментов из различных источников; достаточно однозначно характеризовать активные центры ферментов; предсказывать ход кинетических кривых ферментативной деструкции полимера, величины кинетических параметров ферментативной реакции, а также распределение продуктов ферментативной деполимеризации в ходе гидролиза. Следует отметить, что при всей прогрессивности количественного изучения структуры активных центров карбогидраз, основанного на создании топографической модели активного центра и построении соответствующей математической модели, этим методам присуща принципиальная ограниченность. [13]
При взаимодействии газов с углеродом могут быть выделены следующие стадии реакции: подход молекулы газа к поверхности, адсорбция молекулы газа на поверхности, реакция между адсорбированными молекулами газа и углерода, десорбция продуктов реакции, диффузия продуктов реакции от поверхности в объем газовой фазы. В зависимости от условий проведения опытов ( температуры, давления газа, скорости потока) ход реакции углерода с газами лимитируется разными стадиями, и скорость реакции может иметь различную зависимость от концентрации реагентов и температуры. Результатом этого является значительное расхождение в величинах кинетических параметров реакции, определенных различными исследователями: ее порядка и энергии активации, в связи с тем, что каждая из вышеописанных стадий имеет свою энергию активации. [14]
Анодный разряд галогенидных ионов дает различные продукты в зависимости от материала электрода, природы растворителя и температуры. Так, на платиновом электроде во многих случаях относительно легко достигается установление обратимых электродов второго рода, поскольку растворение металла в пределах потенциалов, соответствующих разряду галогенидных ионов, незначительно. Механизм реакции не зависит от природы растворителя, влияние последнего сказывается лишь на величине кинетических параметров, главным образом токов обмена системы. Как правило, скорость определяющей ступенью является образование тригалогени-да. Для йодидов эта схема, пожалуй, единственна. [15]
Страницы: 1