Разность - равновесный потенциал
Cтраница 1
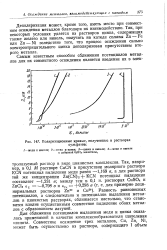 |
Поляризационные кривые, полученные в растворах сульфатов. [1] |
Разность равновесных потенциалов, а следовательно и потенциалов выделения металлов в цианистых растворах, сближается настолько, что становится вполне осуществимым совместное выделение обоих металлов с образованием латуней. [2]
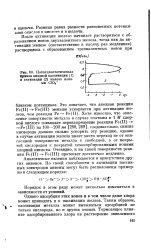 |
Потенциостатическая кривая анодной пассивации ( 1 и активации ( 2 железа ионами СЮ4. [3] |
Разница равна разности равновесных потенциалов окислов в кислоте и в щелочи. [4]
ЭДС элемента равна разности равновесных потенциалов положительного и отрицательного электродов. [5]
Теоретическое напряжение разложения равно разности равновесных потенциалов анода и катода в условиях электролиза. [6]
Электродвижущая сила ТЭ является разностью равновесных потенциалов электродов, которые определяются уравнением Нернста. [7]
Мерой окислительной способности гетерофазной системы редоксит - раствор является разность равновесных потенциалов. [8]
Из (8.3) следует, что коррозия нарастает с увеличением разности равновесных потенциалов катодных и анодных участков, уменьшением суммы сдвигов их потенциалов при прохождении тока и снижением омического сопротивления коррозионной системы. [9]
Очевидно, что при отсутствии перенапряжения на электродах напряжение разложения равно разности равновесных потенциалов электродов. [10]
В последнем уравнении величина В заменяет сумму пред-логарифмических коэффициентов Ьм Ьн, а через Aq обоз начена разность равновесных потенциалов фн - фм. [11]
В отдельных случаях при образовании катодных включении точечная и язвенная коррозия может полностью объясняться локальными токами, возникающими вследствие разности равновесных потенциалов включений и твердого раствора, при этом величина стационарного потенциала будет ниже равновесного потенциала катодных включений. На развитие точечной коррозии могут оказывать существенное влияние разностный эффект, в ряде случаев усиливающий скорость растворения и возможность осуществления реакции типа Me - f - 2Me - ЗМе за счет продуктов анодного растворения. [12]
Разность потенциалов между катодными и анодными участками в ходе процесса постоянна ( так же как и сопротивление электролита) и прямо пропорциональна разности равновесных потенциалов металлов. Это может оправдываться для установившегося во времени процесса. [13]
 |
Типы зондов, применяемые для измерения потенциала в объеме раствора.| Схема для измерения распределения тока на электродах ( / с помощью наложенного зонда ( 2. [14] |
Лучшие результаты получаются при этом тогда, когда зонд и электроды изготовлены из одного металла, поскольку в этом случае сводится к нулю разность равновесных потенциалов. Но так как большинство металлических электродов недостаточно обратимы, при протекании тока через измерительную цепь на границе металл зонда - раствор электролита возникает заметная поляризация, искажающая результаты измерения. [15]
Страницы: 1 2